微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
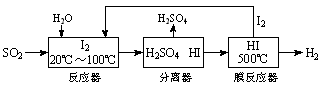
请回答下列问题:
(1) 已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为____________________________________________________。
(2) 该循环工艺过程的总反应方程式为______________________________________。
(3) 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是___________________________________________________________________________。
(4) 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为: NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________。
2、填空题 在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:CO(g)+H2O(g)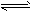 CO2+H2(g) ΔH<0
CO2+H2(g) ΔH<0
已知CO的浓度变化如图所示。
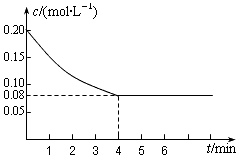
(1)从0~4min,该反应的平均速率v(CO)=_________mol/(L·min)。该反应的平衡常数为___________。
(2)为了增大CO的转化率,可以采取的措施有_________。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为_________mol/L。
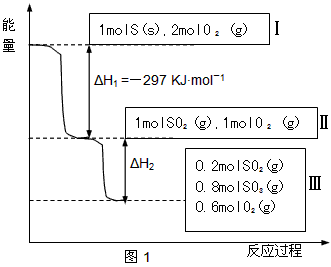
3、填空题 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:
2SO2(g)+O2(g)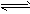 2SO3(g) △H= -196.6 KJ·mol-1)
2SO3(g) △H= -196.6 KJ·mol-1)
请回答下列问题
(1)写出能表示硫的燃烧热的热化学方程式:____________________________。
(2)ΔH2=_____________KJ·mol-1
(3)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比∣ΔH2 ∣__________ (填“大”“小”或“相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______________,若溶液中发生了氧化还原反应,则该过程的离子方程式为______________________。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有_______________。
a.升高温度; b.充入He气 c.再充入1molSO2(g)和1molO2 (g) d.使用催化剂
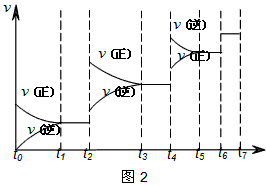
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________________;图中表示平衡混合物中SO3的含量最高的一段时间是________________________。
4、选择题 在相同的条件下,下列说法错误的是( )
A.氯气在饱和和食盐水中的溶解度小于在纯水中的溶解度
B.硫在二硫化碳中的溶解度大于在酒精中的溶解度
C.NH3H2O在NH4Cl溶液中电离的程度大于在纯水中电离的程度
D.工业上生产硫酸的过程中使用过量的空气可提高SO2的利用率
5、选择题 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应: 2X (g)+Y (g)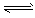 Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是 [???? ]
Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是 [???? ]
A.以X浓度变化表示的反应速率为0.02mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数减小,则该反应的△H>0