微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对Na2O2的叙述中,正确的是
A.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
B.Na2O2能与水反应,所以Na2O2可做干燥剂
C.Na2O2与水反应时,Na2O2只作氧化剂
D.Na2O2与CO2反应时,Na2O2既是氧化剂,又是还原剂
参考答案:D
本题解析:
试题分析:A.Na2O2能与酸反应生成盐和水,还有氧气,所以Na2O2不是碱性氧化物,A项错误;B.Na2O2能与水反应,生成NaOH和氧气,所以Na2O2不能做干燥剂,B项错误;C.Na2O2与水反应时,氧元素一部分得电子化合价降低,一部分失电子化合价升高,Na2O2既作氧化剂,又做还原剂,C项错误;D.Na2O2与CO2反应时,氧元素一部分得电子化合价降低,一部分失电子化合价升高,Na2O2既是氧化剂,又是还原剂,D项正确;选D。
考点:考查氧化还原反应的基本概念,Na2O2的性质等知识。
本题难度:一般
2、选择题 下列有关化学反应速率的说法正确的是 ?
A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
参考答案:A
本题解析:试题分析:对于有气体参加的化学反应,降低压强,反应速率降低,A正确;B中氯化钠溶液相当于是稀释盐酸,反应速率降低,B错误;升高温度反应速率一定是增大的,C不正确;浓硫酸在铁在常温下发生钝化,得不到氢气,D不正确,答案选A。
考点:考查外界条件对反应速率的影响
点评:该题是基础性试题的考查,也是高考中的常见考点和题型,难度不大。该题的关键是熟练记住外界条件对反应速率影响的变化规律,然后灵活运用即可。
本题难度:困难
3、选择题 标准状况下,将1g氦气、11g二氧化碳和4g氧气混合,该混合气体的体积约
A.8.4L
B.11.2L
C.14.0L
D.16.8L
参考答案:C
本题解析:
本题难度:困难
4、选择题 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:? 5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”?电池在海水中放电时的有关说法正确的是
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移1 mol电子
C.Na+不断向“水”电池的正极移动
D.AgCl是还原产物
参考答案:C
本题解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,选项A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,选项C正确;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B不正确,答案选C。
本题难度:一般
5、选择题 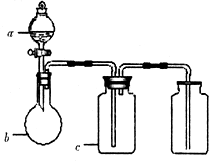 拟用如图装置制取表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),不能达到实验目的是
拟用如图装置制取表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),不能达到实验目的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:根据反应装置知,反应物必须是固液混合物且不需要加热,根据洗气装置知,气体不能与洗液反应,否则收集不到气体,根据干燥装置知,干燥剂只能吸收水不能和收集气体反应,该装置收集的气体密度比空气大,据此分析解答.
解答:A.双氧水在二氧化锰的催化作用下分解产生氧气不需加热,氧气不与浓硫酸作用,可用浓硫酸吸收水分进行干燥,氧气密度比空气大,能用向上排空气法收集,故A正确;
B.盐酸和大理石反应制取二氧化碳不需加热,二氧化碳中混有易挥发的氯化氢,二氧化碳与碳酸氢钠不反应,氯化氢与碳酸氢钠反应生成氯化钠和二氧化碳和水,能用碳酸氢钠进行洗涤二氧化碳,二氧化碳密度比空气大,能用向上排空气法收集,故B正确;
C.铜和稀硝酸反应生成一氧化氮不需要加热,但一氧化氮难溶于水,所以不能用水洗,一氧化氮和氧气反应生成二氧化氮,所以不能用排空气法收集,故C错误;
D.亚硫酸钠固体与硫酸反应Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,不需加热,SO2不与浓硫酸作用,可用浓硫酸吸收水分进行干燥,SO2密度比空气大,能用向上排空气法收集,故D正确;
故选C.
点评:本题考查常见气体的制取和干燥,明确气体的性质是解答本题关键,题目难度不大.
本题难度:一般