微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
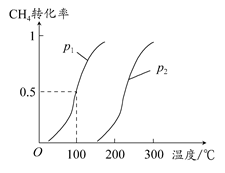
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号
| T(°C)
| n(CO)/n(H2)
| p(MPa)
|
ⅰ
| 150
| ??
| 0.1
|
ⅱ
| ________
| ________
| 5
|
ⅲ
| 350
| ________
| 5
?
参考答案:(1)①0.0030 mol·L-1·min-1 ②<
本题解析:(1)在100°C时,CH4的转化率为0.5,则有
CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g)
起始:? 1.0 mol? 2.0 mol? 0? 0
变化:? 0.5 mol? 0.5 mol? 0.5 mol? 1.5 mol
平衡:? 0.5 mol? 1.5 mol
本题难度:一般
2、选择题 在一定温度下的定容密闭容器中,反应:A(s)+2B(g) C(g)+D(g)达到平衡的标志是( ) C(g)+D(g)达到平衡的标志是( )
A.混合气体的压强 B.单位时间生成2n mol的B同时消耗n mol的D
C.混合气体的密度 D.A、B、C、D物质的量之比为1:2:1:1
参考答案:C
本题解析:
试题分析:达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答。
A项:该反应是一个反应前后气体体积不变的化学反应,反应容器中气体的压强一直发生变化,故错;B项:无论该反应是否达到平衡状态,单位时间生成2n mol的B同时消耗n mol的D,故错;D项:物质的物质的量之比不能来判断是否处于平衡状态,故错。故选C。
考点:化学平衡状态的判断
点评:本题考查化学平衡状态的判断,题目难度不大,本题注意C项为易错点,注意反应前的计量数等于反应后各物质的计量数之和,但反应前后气体的物质的量发生改变。
本题难度:简单
3、选择题 下列说法正确的是(??)
A 活化分子的每一次碰撞都能够发生化学反应
B 反应物用量增加后,有效碰撞次数增多,反应速率增大
C 能够发生有效碰撞的分子叫做活化分子???
D 加入催化剂对化学反应速率无影响
参考答案:C
本题解析:A 并不是活化分子的每一次碰撞都能够发生化学反应,只有方向合适才会发生有效碰撞,A错;
B 固体或纯液体用量的增加不会影响反应速率;B错;
C 能够发生有效碰撞的分子叫做活化分子,正确;
D 加入催化剂会加快化学反应速率,D错
选C.
本题难度:简单
4、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)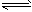 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表

回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________。
(2)该反应为_________反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_________(多选扣分)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O)
d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
_________℃。
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:一般
5、选择题 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:
CO+HbO2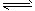 O2+HbCO ,37 ℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是[???? ] O2+HbCO ,37 ℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是[???? ]
A.CO与HbO2反应的平衡常数K=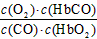
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
参考答案:C
本题解析:
本题难度:一般
|