微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铜既不溶于稀硫酸,也不溶于KNO3溶液,现有2mol/L稀硫酸15mL,往其中加入2.02g KNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为
A.0.0075mol
B.0.0225mol
C.0.03mol
D.0.0175mol
参考答案:B
本题解析:2mol/L稀硫酸15mL的物质的量为0.03mol,氢离子的物质的量为0.06mol,2.02g KNO3晶体的物质的量为0.02mol;当向混合溶液中加入铜,发生反应的离子方程式为: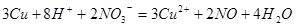 ;由方程式可知硝酸根离子物质的量过量,即氢离子完全反应,消耗铜的物质的量为0.0225mol,
;由方程式可知硝酸根离子物质的量过量,即氢离子完全反应,消耗铜的物质的量为0.0225mol,
本题难度:简单
2、简答题 某同学采用如图所示装置进行Fe粉与水蒸气的反应.
(1)写出Fe粉与水蒸气反应的化学方程式______.
(2)该同学向反应后的固体中加入过量的稀HCl,并将溶液分装在两支试管中.
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______.
②向第二支试管中加入适量铁粉.该过程中发生化合反应的离子方程式是______.
再向所得溶液中滴加NaOH溶液并放置一段时间,该步反应中的实验现象是______.发生的氧化还原反应的化学方程式是______.
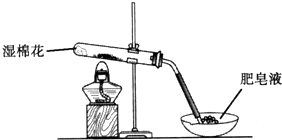
参考答案:(1)该反应的化学方程式是:3Fe+4H2O(g)
本题解析:
本题难度:简单
3、填空题 某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有Si O2、A12O3等杂质)提取Fe2O3。操作讨程如下:
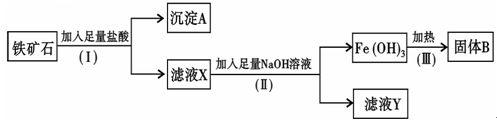
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是??????????;
(2)沉淀A中主要含有??? ??????(填化学式),固体B是?????????(填化学式);
??????(填化学式),固体B是?????????(填化学式);
(3)滤液Y中的阴离子除OH-、Cl-外,还有?????????(填化学式);
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式???????????????????????????
参考答案:(6分)
(1)过滤???
(2)? SiO2?
本题解析:略
本题难度:一般
4、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
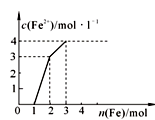
A.2∶1∶4
B.1∶2∶4
C.1∶2∶1
D.1∶1∶4
参考答案:D
本题解析:根据强者优先规则,氧化性强的要先与铁粉反应。
反应顺序为:Fe+4HNO3=Fe(NO3)3+NO+4H2O,此反应消耗1molFe,故有4molHNO3反应,同时生成1molFe(NO3)3。
2Fe(NO3)3+Fe=3Fe(NO3)2,此反应消耗1molFe,故有2molFe(NO3)3反应,但上一步生成了1molFe(NO3)3,故稀溶液中的Fe(NO3)3为1mol。
Cu(NO3)2+Fe=Fe(NO3)2+Cu,该反应消耗1molFe,故有1molCu(NO3)2反应。
本题难度:一般
5、选择题 足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
A.①②
B.②③
C.③④
D.①④
参考答案:B
本题解析:
试题分析:CO还原铁的氧化物生成CO2,CO2与氢氧化钙反应生成碳酸钙,即25g是碳酸钙的质量,物质的量=25g÷100g/mol÷0.25mol。则根据原子守恒可知CO CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的
CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的
本题难度:简单