微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 要除去FeCl2溶液中少量的FeCl3,可行的方法是
A.滴入KSCN溶液
B.通入氯气
C.加入适量铜粉并过滤
D.加入适量铁粉并过滤
参考答案:D
本题解析:
试题分析:硫氰化钾溶液用于检验Fe3+,FeCl3+3KSCN Fe(SCN)3+3KCl,引入了新杂质,A错误;氯气与氯化亚铁溶液反应,B错误;铜与氯化铁反应生成氯化铜和氯化亚铁,引入了新杂质,C错误;铁与氯化铁生成氯化亚铁,过量的铁粉过滤除去,D正确。
Fe(SCN)3+3KCl,引入了新杂质,A错误;氯气与氯化亚铁溶液反应,B错误;铜与氯化铁反应生成氯化铜和氯化亚铁,引入了新杂质,C错误;铁与氯化铁生成氯化亚铁,过量的铁粉过滤除去,D正确。
点评:除杂质时要注意不能引入新的杂质、不能
本题难度:一般
2、选择题 2010年上海世博会中国馆(东方之冠)给人强烈的视觉冲击,它的主体结构是用国产Q460钢制成的。下列有关说法正确的是(?)
A.冶炼钢铁常采用热分解法
B.Q460是含铁、碳、硅、锰、硫、磷等元素的合金钢,其中铁和锰不属于主族元素
C.铝热法炼铁的反应需要高温的条件,所以是吸热反应
D.增加炼铁高炉的高度可以减少尾气CO的排放
参考答案:B
本题解析:冶炼钢铁常采用热还原法,A项错误。铁属于第Ⅷ族,锰属于第ⅦB族,B项正确。铝热反应属于放热反应,C项错误。增加炼铁高炉的高度并不能减少CO的排放,D项错误。
本题难度:一般
3、选择题 向盛有a g镁铝合金的烧杯中加入cl mol/L稀硫酸V1L,合金完全溶解后,再加入c2mol/L的 NaOH溶液V2L,生成沉淀的质量恰好达到最大值bg。则下列关系式不正确的是(??)
A.2c1V1=c2V2
B.反应产生氢气的质量m(H2)= 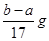
C.b≤a+17c2V2
D.合金中含镁的质量分数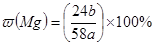
参考答案:D
本题解析:
分析:A、加入氢氧化钠溶液后,沉淀达到最大值,说明镁离子和铝离子都生成了沉淀,溶液中的溶质为硫酸钠,所以2n(Na+)=n(SO42-),2c1V1=c2V2,
B、根据镁、铝与硫酸后再与氢氧化钠的化学方程式,可得到关系式:2Al~3H2~2Al(OH)3,Mg~H2~Mg(OH)2,n(H2)= 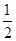
本题难度:一般
4、填空题 (本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤
| 操作
| 现象
|
Ⅰ
| 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液
| 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅱ
| 用激光笔照射步骤I中的红褐色溶液
| 出现“丁达尔效应”
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅲ
| 向1 mol?L-1的FeCl3溶液中通入一定量的SO2
| 溶液由黄色变为红褐色
| Ⅳ
| 用激光笔照射步骤Ⅲ中的红褐色溶液
| 没有出现“丁达尔效应”
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液?????????b.KSCN溶液????????c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因???????。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
参考答案:(1)<(1分) (2) ① Fe3++3H2O![]()
本题解析:
试题分析:(1)氯化铁是强酸弱碱盐,铁离子水解溶液显酸性,因此常温下,FeCl3溶液的pH<7。
(2)① 在氯化铁溶液中存在铁离子的水解平衡:Fe3++3H2O Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。 Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。
②铁离子具有氧化
本题难度:一般
5、填空题 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:

①[Cu(NH3)4]SO4中所含的化学键有?????、?????、??????,
N、O、S三种元素的第一电离能大小顺序为:?????>?????>??????。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为:????????????????????????。
③? NH3分子中N原子的杂化方式为:?????????????。
④与SO2互为等电子体的分子有????????????????(写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点???????????。(填“高”或“低”)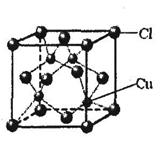
参考答案:⑴①?离子键 、?共价键 、 配位键 ,? N?>? O?>
本题解析:略
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772