微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,将1.92g铜加入到100mlH2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气。下列有关结论不正确的是(???)
A.溶解的铁粉为2.8g
B.原溶液中C(SO42-)=0.5mol/L
C.原混合溶液中C(H+)=1.2mol/L
D.原溶液中n(NO3-)=0.08mol
参考答案:D
本题解析:铜的物质的量为0.03mol,氢气的物质的量为0.02mol;发生的反应依次分别为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
0.03? 0.08? 0.02?? 0.03
Fe?+?Cu2+=Cu+Fe2+
0.03??? 0.03
Fe?+?2H+= Fe2++H2
0.02??? 0.04?????????0.02
可知,原溶液中NO3-的物质的量为0.02mol,H+的物质的量为0.12mol,即可求出SO42—的物质的量为0.05mo
本题难度:简单
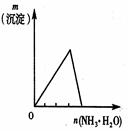
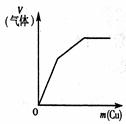
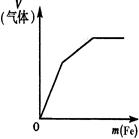
2、选择题 下列反应中,相关示意图像错误的是(???)
A
| B
| C
| D
|
将二氧化硫通入到一定量氯水中
| 将氨水滴入到一定量氯化铝溶液中
| 常温下将铜粉加入到一定量浓硝酸中
| 常温下将铁粉加入到一定量浓硝酸中
|

| 
| 
| 
?
参考答案:BD
本题解析:略
本题难度:简单
3、简答题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
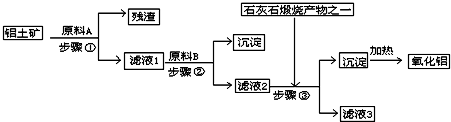
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的离子方程式是:______.
(3)步骤③的化学方程式是:______.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,
本题解析:
本题难度:一般
4、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
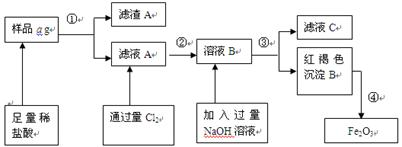
(1)取样品a g,称取时使用的主要仪器名称为_____???_______。
(2)滤液A中溶质主要含有_______???、__???? __ _(写化学式);
操作①的名称?????????,其使用的玻璃仪器有______________________________。
(3)写出由溶液B生成红褐色沉淀B的离子方程式________________________________。
(4) 对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为(用含a、b的式子表示)_____________。
(5)如何验证滤液A中含Fe2+,而不含Fe3+______________________???_____________。
参考答案:(1)托盘天平
(2) FeCl2、AlCl3 ; 过
本题解析:略
本题难度:一般
5、填空题 从铝土矿(主要成分是Al2O3,含RO2、Fe2O3等杂质)中提取Al2O3的一种工艺流程如下:
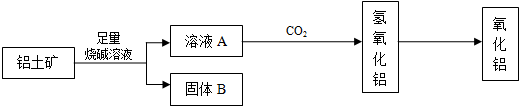
(1)元素R位于周期表中的第三周期,其最高正化合价和负化合价的绝对值相等.RO2的用途有(写出1条即可)______.
(2)铝土矿加入足量烧碱溶液后主要反应的离子方程式为
①______.
②______.
(3)工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝.已知电极材料为惰性材料,阳极反应式为______.
(4)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移3mol?e-,有1.5mol化合物X生成,此反应的化学方程式______.
参考答案:(1)最高正化合价和负化合价的绝对值相等,则最外层电子数为4
本题解析:
本题难度:一般
|