微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4
B.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
C.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
D.常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③
参考答案:A
本题解析:
试题分析:A、浓度均为0.1 mol·L-1的4种溶液中,NaOH溶液的碱性最强,pH最大,NaHSO4溶液的酸性最强,pH最小,Na2CO3水解使溶液显碱性,(NH4)2SO4水解使溶液显酸性,所以pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4,正确;B、若H2A是强酸,则NaHA溶液的pH<7, 若H2A是弱酸,则NaHA溶液的pH不确定,须看HA-的水解程度与电离程度的大小比较,所以pH<7不能判断H2A是强酸,错误;C、醋酸
本题难度:一般
2、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时,有
HA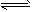 H++A-,则K=
H++A-,则K=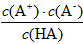 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)

回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是_______________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是___________________________。
参考答案:(1)增大
(2)K值越大,电离出的氢离子浓度越大,
本题解析:
本题难度:一般
3、选择题 下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
参考答案:A.常温下,pH=7的溶液中c(H+)=c(OH-),溶液中
本题解析:
本题难度:简单
4、选择题 某温度时,向pH=6的蒸馏水中加入少量硫酸氢钠晶体,温度不变测得溶液的pH=2,下列说法不正确的是:
A.此时溶液的c(H+)= 1×10-2mol·L-1
B.溶液中水电离出的c(H+)= 1×10-12mol·L-1
C.H2O的电离程度随温度升高而增大
D.c(H3O +)> c(SO42—)
参考答案:B
本题解析:硫酸氢钠溶于水电离出氢离子,抑制水的电离。蒸馏水的pH=6,说明温度不是常温,该温度下水的离子积常数为10-12,所以溶液中水电离出的氢离子浓度是1×10-10mol/L,即选项B不正确,其余都是正确的,答案选B。
本题难度:简单
5、选择题 已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol/L、Ka(HF)= 6.8×10-4 mol/L、Ka(CH3COOH)= 1.8×10-5 mol/L、Ka(HNO2)= 6.4×10-6mol/L。则物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是
A.NaCN
B.NaF
C.CH3COONa
D.NaNO2
参考答案:B
本题解析:
试题分析:由这几种弱酸在相同温度下的电离平衡常数可以判断酸性:HF> CH3COOH > HNO2> HCN。酸越弱,相同条件下相同浓度的其相应的Na盐水解程度越大,溶液的碱性就越强,PH就越大。故物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是NaF。选项为:B.
本题难度:一般