微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组热化学方程式中,△H前者大于后者的是 [???? ]
①C(s)+O2(g)=CO2(g); C(s)+1/2O2(g)=CO(g)
②S(s)+O2(g)=SO2(g); S(g)+O2(g)=SO2(g)
③H2(s)+1/2O2(g)=H2O(l); 2H2(g)+O2(g)=2H2O(l)
④2KOH(aq) +H2SO4(aq)=K2SO4(aq)+2H2O (l);2KOH (aq) +H2SO4(浓)=K2SO4(aq)+2H2O(l)
A.①③
B.②④
C.②③④
D.①②③
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
A.4a+4b+4c
B.2a-2b+6c
C.2a-2b+2c
D.2a-6b+2c
参考答案:B
本题解析:酒精液体完全燃烧恢复到室温,生成的产物为CO2(g)和H2O(l),根据已知的热化学方程式可知:
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol ①,C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol ②,H2O(g)=H2O(l) ΔH3=
-c kJ/mol ③。常温下C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)的热化学方程式为①-②+3×③,C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
ΔH=-(a-b+3c) kJ·mol-1,92 g C2H5OH的物质的量为2 mol,反应放出的热量为(2a-2b+6c) kJ,B项正确。
本题难度:一般
3、选择题 下列有关热化学方程式及其叙述正确的是 [???? ]
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:
2H2O(l)=2H2(g)+O2(g);△H=+571.0 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g) 2NH3(g) ;△H=-92.4 kJ·mol-1,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
2NH3(g) ;△H=-92.4 kJ·mol-1,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1366.8 kJ·mol-1和1411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l);△H=-44.2kJ·mol-1
参考答案:AD
本题解析:
本题难度:简单
4、选择题 已知(l)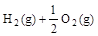 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·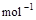
(2)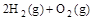 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·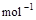
(3)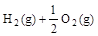 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·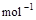
(4)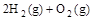 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·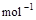
下列关系式中正确的是( )
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
试题分析:由于气态水的能量高于液态水的能量,所以等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量不相同,后者放出的热量多。但放热越多,△H越小,即0>b>d、0>a>c。反应放出的热量与消耗氢气的物质的量成正比,所以2a=b<0、2c=d<0,答案选C。
考点:考查反应热的有关计算和判断
点评:该题是中等难度的试题,也是高考中的常见题型、试题设计新颖,基础性强,注重答题的灵活性。有利于激发学生的学习求知欲,调动学生的学习兴趣。该题还需要明确的是在比较反应热大小时,要带着“-”和“+“进行比较。
本题难度:简单
5、填空题 如图所示,写出反应的热化学方程式, 并回答问题。
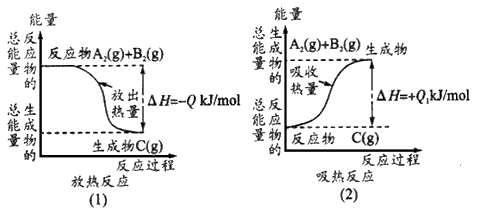
(1)反应过程(1)的热化学方程式为:______________。
(2)反应过程(2)的热化学方程式:_____________。
(3)Q与Q1的关系:Q_______(填“大于”“等于” 或“小于”)Q1。
参考答案:(1)A2 (g)+B2(g) =C(g) △H=-QkJ/
本题解析:
本题难度:一般