微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 智利硝石与浓硫酸可用于制硝酸:NaNO3 + H2SO4(浓)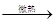 ?NaHSO4+HNO3↑。该反应说明
?NaHSO4+HNO3↑。该反应说明
A.硫酸比硝酸稳定
B.硫酸的沸点比硝酸高
C.H2SO4的酸性比硝酸强
D.浓硫酸的氧化性比硝酸强
参考答案:B
本题解析:
正确答案:B
B、正确,该反应用的原理是:高沸点制低沸点。
本题难度:简单
2、实验题 用如下图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
B中棉花的位置
| ①
| ②
| ③
|
所蘸试剂
| 石蕊试液
| 品红溶液
| 碘水(黄色)
|
现象
| ?
| 褪色
| ?
|
体现SO2的性质
| 水溶液显酸性
| ?
| ?
?
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液?②蘸有淀粉KI溶液?③蘸有石蕊溶液?④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。
参考答案:I.(1)分液漏斗(1分)
现象
变红(1分)<
本题解析:
试题分析:I.(1)图中仪器p为分液漏斗;SO2溶于水生成H2SO3显酸性,所以石蕊变红;SO2使品红褪色,体现了SO2的漂白性;SO2通入碘水中,SO2被I2氧化,所以碘水褪色,体现了SO2的还原性。
(2)SO2、H2O与I2反应生成HI和H2SO4,HI和H2SO4为强电解质,拆成离子可得离子方程式。
II.(1)Cl2把FeCl2氧化为FeCl3,把FeCl2和FeCl3改写为离子可得离子方程式。
(2)Cl2与H2O反应生成HCl和HClO,显酸性使石蕊变红,HClO具
本题难度:一般
3、选择题 已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、高压、使用催化剂
参考答案:A
本题解析:X为浓硫酸,使蔗糖变黑主要体现了浓硫酸的脱水性;常温下铁遇到浓硫酸会钝化;若A为碳,则C为CO2,过量的CO2通入澄清石灰水中没有沉淀产生;SO2转化成SO3是在催化剂作用下400~500 ℃、常压下进行的。
本题难度:一般
4、选择题 某气体通入品红溶液中,溶液褪色.加热后又恢复为原来颜色.该气体是
A.SO2
B.NO2
C.CO2
D.Cl2
参考答案:A
本题解析:分析:二氧化硫具有漂白性,是因利用化合反应生成暂时稳定的无色化合物,加热时该化合物分解,品红又恢复成红色.
解答:A.SO2是一种漂白剂,能使品红褪色,但是生成的无色物质不稳定,加热时该化合物分解,二氧化硫从溶液中逸出,因此品红溶液又恢复原来颜色,故A正确;
B.NO2不是漂白剂,通入品红溶液中,溶液不褪色,故B错误;
C.CO2不是漂白剂,通入品红溶液中,溶液不褪色,故C错误;
D.Cl2与水反应生成次氯酸,次氯酸是一种漂白剂,能使品红褪色,加热后颜色不变,故D错误;
故选A.
点评:本题主要考查了物质的漂白性,难度不大,注意区分.
本题难度:一般
5、选择题 下列实验用来证明SO2的存在,其中正确的是
①能使品红溶液褪色②能使湿润的蓝色石蕊试纸变红③能使澄清的石灰水变浑浊④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸⑤通入溴水能使溴水褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成
A.都能证明
B.都不能证明
C.①⑤能证明
D.只有⑤能证明
参考答案:D
本题解析:①错,能使品红溶液褪色的气体有二氧化硫或氯气等气体;②错,能使湿润的蓝色石蕊试纸变红的气体除二氧化硫外还可以是HCL气体等;③错,能使澄清的石灰水变浑浊的气体可以是二氧化硫或二氧化碳气体;④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸的气体可以是二氧化硫或二氧化碳气体;⑤正确;
本题难度:一般
|