微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某样品含亚硫酸钠和少量的硫酸钠。现取一定量样品溶于100mL水配成溶液,再加足量的氯化钡溶液,过滤、洗涤、干燥,得沉淀13.18g。若将这些固体中加入足量的稀盐酸,充分反应后,再过滤、洗涤、干燥,得固体不溶物为2.33g。则:(1)样品中亚硫酸钠的物质的量为多少? (2)样品中硫酸酸钠的质量分数为多少?
参考答案:(1)0.05 mol
(2)0.184
本题解析:(注:解题过程必须详细、完整、按步骤给分)。
Na2SO4+BaCl2=BaSO4↓+2NaCl
硫酸钡:2.33g/233g?mol-="0.01mol?" 硫酸钠:1.42g
Na2SO3+BaCl2=BaSO3↓+2NaCl
亚硫酸钡:13.18g — 2.33g =" 10.85" g
亚硫酸钠:6.3g??? n="0.05" mol
硫酸钠的质量分数:1.42g/(1.42+6.3)g= 0.184
本题难度:简单
2、选择题 “飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7 m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2接触时,SO2会转化为SO3,使空气酸度增加。飘尘所起的主要作用与下列变化中硫酸的作用相同的是( )。
A.氯气除杂过程中通入浓硫酸中
B.浓硫酸与木炭共热
C.乙酸乙酯与稀硫酸共热
D.浓硫酸滴到蔗糖中制“黑面包”
参考答案:C
本题解析:“飘尘”与空气中的SO2、O2接触时,SO2会转化为SO3,则“飘尘”在该反应中起催化作用。氯气通入浓硫酸中除水蒸气,浓硫酸表现了吸水性;浓硫酸与木炭共热,浓硫酸表现了强氧化性;乙酸乙酯与稀硫酸共热时,乙酸乙酯水解,稀硫酸起催化作用;浓硫酸滴到蔗糖中制“黑面包”时,浓硫酸表现了脱水性。
本题难度:一般
3、选择题 H2SO4是SO3的水合物,设某种(90%)浓H2SO4中存在着三种水合物形式:H2SO4(SO3·H2O)、H2S2O7(2SO3·H2O)、H2SO4·2H2O(SO3·3H2O)。若SO3·3H2O的质量占了一半,那么H2SO4与H2S2O7的物质的量之比为(???)
A.1∶1
B.98∶168
C.163∶191
D.168∶191
参考答案:C
本题解析:令SO3·3H2O为50g,则浓H2SO4为100g;H2SO4写成SO3·H2O,则
m(SO3)=90g×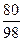 =73.47g
=73.47g
m(H2O)=16.53g
在50gSO3·3H2O中,
m(SO3)=50g× 本题难度:简单
本题难度:简单
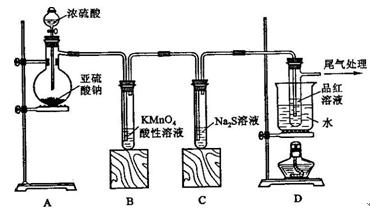
4、填空题 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是?????????????,其中发生反应的化学方程式为???????????;
(2)实验过程中,装置B、C中发生的现象分别是??????????、??????????,这些现象分别说明SO2具有的性质是?????????和??????????;装置B中发生反应的离子方程式为?????????????????;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象??????????????????;
(4)尾气可采用????????????溶液吸收。
参考答案:(1)蒸馏烧瓶?? Na2SO3+H2SO4(浓)= Na2
本题解析:
试题分析:该实验为制备SO2并检验其性质,则A为SO2的发生装置,B、C、D为检验装置;B中为酸性高锰酸钾溶液。它具有强氧化性能把SO2氧化成H2SO4,它本身被还原为Mn2+,溶液的紫色变浅或褪去。故可用于检验SO2的还原性;C中为硫化钠溶液,其具有强还原性二者发生反应产生难溶于水的S单质,看见溶液变浑浊,故可用于检验SO2的氧化性;D中为品红溶液,可检验SO2的漂白性;SO2的漂白是结合漂白,产生的无色物质不稳定,受热容易分解而恢复原来的红色。SO2是大气污染物,它是酸性氧化物,可用碱性溶液N
本题难度:一般
5、选择题 把含硫48%的硫铁矿先制成硫酸,再吸收氨气制成硫酸铵。1 t这种硫铁矿在理论上能制得硫酸铵()
A.1.06 t
B.1.98 t
C.2.14 t
D.2.26 t
参考答案:B
本题解析:FeS2中的S的含量为 ×100%=53.3%,而题目中所提供的硫铁矿中含硫48%,所以不能以FeS2进行计算,需根据矿石的含硫量及S原子守恒得关系式:
×100%=53.3%,而题目中所提供的硫铁矿中含硫48%,所以不能以FeS2进行计算,需根据矿石的含硫量及S原子守恒得关系式:
2S~2SO2~2SO3~2H2SO4~2(NH4)2SO4
64 t??????????????????????? 2×132 t
1 t×
本题难度:简单