结论
分别向A、B溶液中加KSCN溶液
______
固体物质中FeCl3
分别向KMnO4溶液中加入适量A、B溶液
KMnO4溶液颜色无明显变化
固体物质中不含______
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式______.
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是______?(填写序号).
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式______.腐蚀后的废液中含有FeCl2、FeCl3、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:______.
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作______极,该电极上所发生的电极反应为?(若有多个电极反应,请全部写出)______.方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:______.
参考答案:(2)A是FeCl3,B是FeCl2,分别向A、B溶液中加K
本题解析:
本题难度:一般
2、填空题 强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3 FeCl3
B.Fe+I2 FeI3 FeI3
C.Fe+CuSO4 FeSO4+Cu FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2 CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2 FeCl2+Br2
F.FeI2+Br2 FeBr3+I2 FeBr3+I2
参考答案:(1)A-
(2)否 因为在液氨中醋酸与盐酸都是强酸<
本题解析:(1)由反应H2B(少量)+2A-=B2-+2HA可知,结合质子的能力A-强于B2-,B2-强于HB-。(2)在液氨中,醋酸能完全电离也是强酸。(3)不矛盾,因为反应生成了不溶物CuS。(4)FeBr3+Cl2―→FeCl2+Br2反应中Fe3+不可能被还原为Fe2+;I2的氧化性弱于Fe3+,故I2与Fe反应只能生成FeI2。
本题难度:一般
3、选择题 根据下面三个化学方程式判断有关物质的性质比较正确的是??????
①I2+SO2+2H2O=H2SO4+2HI?? ②2FeCl2+Cl2 = 2FeCl3??③2FeCl3+2HI= 2FeCl2+2HCl+I2
A.氧化性:I2> H2SO4>Cl2> Fe3+
B.还原性:Cl->Fe2+>SO2>I-
C.氧化性:Cl2> Fe3+ >I2> H2SO4
D.还原性:SO2> Fe2+ > I- >Cl-
参考答案:C
本题解析:根据方程中氧化剂的氧化性大于氧化产物,还原剂还原性大于还原产物,可推断氧化性:Cl2> Fe3+ >I2> H2SO4。所以正确答案应该是C。
本题难度:一般
4、选择题 A、B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,A放出的能量大于B.下列叙述中正确的是( )
A.A的还原性小于B
B.B-的氧化性大于A-
C.A-的还原性大于B-
D.A的氧化性大于B
参考答案:非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子
本题解析:
本题难度:一般
5、选择题 贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2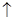 + SeO2+2H2O。下列叙述正确的是( ) + SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
参考答案:D
本题解析:
试题分析:A.在反应①中Se是还原产物,I2是氧化产物,错误;B.在反应②中浓H2SO4是氧化剂,SeO2是氧化产物,错误;C.在反应①中每有1.0mol I2生成,转移电子数目为2 NA,错误;D.在反应中氧化剂的氧化性强于氧化产物的氧化性,所以把两个反应中物质的氧化性强弱结合起来,则SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2,正确。
考点:考查氧化还原反应的概念、电子转移、氧化性强弱的比较的知识。
本题难度:一般
|