微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸和硝酸是中学阶段常见的强酸.根据二者与金属的反应情况,回答下列问题:
(1)①在100mL?18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______.A.33.6L????B.22.4L????C.20.16L????D.6.72L
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子方程式加以说明______.
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是______,反应中所消耗的硝酸的物质的量可能为下列数据中的______.A.0.1mol??B.0.15mol???C.0.2mol???????D.0.25mol.
2、选择题 元素及其化合物是无机化学的重要组成部分,是学习其他化学知识的前提与基础。下列说法中正确的是 [???? ]
A.所有的非金属氧化物均为酸性氧化物
B.由非金属元素构成的化合物不可能为离子化合物
C.浓硫酸能与木炭反应,说明浓硫酸具有强氧化性
D.溴中溶有少量氯气,先加入少量溴化钠溶液再用酒精萃取的方法提纯
3、选择题 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是

[?????]
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.标准状况下,1mol Fe 可与足量的该硫酸反应,产生22.4L气 体时, 转移的电子数为2NA
C.配制200mL 4.6 mol·L-1的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合后所得溶液的质量分数为 49%
4、填空题 校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓)
??△??
.
?
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
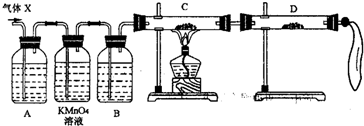
①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A??导管???B??水槽???C??广口瓶???D??容量瓶??E??量筒???F??单孔塞???G??双孔塞.
5、选择题 对下列事实的解释正确的是
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
|