CH3COO-、Cl-、OH-、SO42-
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________????????????????????????????_______。
参考答案:(1)CH3COONa、NH4Cl、Ba(OH)2、Na2S
本题解析:
试题分析::①A、C溶液的pH均大于7,应为醋酸盐和碱溶液,A、B的溶液中水的电离程度相同,则溶液水解程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,则说明C为Ba(OH)2,D为Na2SO4,则B为NH4Cl
(1)根据题中信息推断出各物质分别为:A.CH3COONa,B.NH4Cl,C.Ba(OH)2,D.Na2SO4;
(2)醋酸钠水解呈碱性,离子方程式为CH3COO- + H2O  本题难度:一般 本题难度:一般
3、判断题 有一结晶水合物X·6H2O,其水溶液为浅绿色,可发生如下的转化(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,G为难溶于水的红褐色固体。在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀。
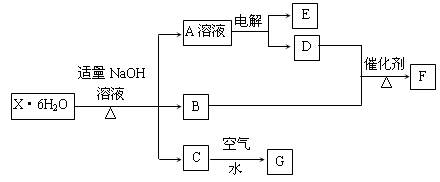
请回答下列问题:
⑴指出C→G的基本反应类型:_________反应。
⑵用惰性电极电解溶液A时得到E的电极反应式为____________________________。
⑶B与D反应生成F的化学方程式为__________________________________。
⑷该晶体水合物的化学式为_________________________________。
(5)在空气中灼烧X·6H2O晶体能否得到X无水盐?????(填:能或否),理由是????????????。
参考答案:
⑴化合⑵2H++2e-=H2↑?⑶4NH3+5O2<
本题解析:
根据框图和题干信息,A溶液中含有SO42-,G为氢氧化铁,逆推C为氢氧化亚铁;B、D、E、F均为无色气体,说明它们可能是中学化学中O2,H2,NO,NH3,CO,CO2,SO2等。由A和C成分逆推X可能含有FeSO4;
由“X·6H2O与氢氧化钠溶液,加热”生成无色气体B,中学只有铵盐与碱反应生成无色气体氨气,所以,X中含有NH4+,B为NH3,氨与氧气发生催化氧化,D为氧气;X与氢氧化钠反应,A为硫酸钠,电解硫酸钠水溶液,实质是电解水,产物是氢气(E)和氧气(D)。综合分析知,X为FeSO
本题难度:一般
4、填空题 (12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为????????,B的化学式是???????????。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是?????(填字母代号)。
A.+99.7kJ·mol-1???????????????????????????????????????????????????????????????????????????????????????B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1???????????????????????????????????????????????????????????????????????????????????????D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式??????????。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式????????????????????????。
(4)X、Y两种元素形成的离子化合物的电子式为?????????????。
参考答案:(1)NaOH、NaHS??(2)B
(3)H2O2+
本题解析:Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐,说明Y是N元素。Z原子最外层电子数与核外电子总数之比为3:4,因为最外层电子不能超过8个,所以Z最外层含有6个电子,是氧元素。M可与Z形成阴、阳离子个数比为1:2的两种化合物,则M是钠元素。Q原子的最外层电子数与次外电子数之比为3:4,因为最外层电子不能超过8个,所以Q得最外层含有6个电子,次外层有8个电子,在短周期元素中是硫元素。YX3常温下为气体,且X的原子序数最小,该该化合物是氨气,即X为氢元素。
(1)由H、O、Na、S四种元素中的三种组
本题难度:简单
5、填空题 有三种固体物质和五种溶液:固体是铁粉、铜粉、氢氧化铜;溶液是CuSO4溶液、NaOH溶液、FeSO4溶液、H2SO4溶液、Na2SO4溶液.它们中的几种物质在常温下相互转化关系如下:
(1)溶液A+溶液C→固体甲+溶液D
(2)固体乙+溶液B→溶液E+氢气
(3)固体甲+溶液B→溶液C+水
试推断溶液中A、B、C、D、E及固体甲、乙、丙的名称.
A、______??B、______????乙、______?丙、______
写出反应(1)(3)的方程式:
(1)______(3)______.
参考答案:依据转化关系,固体乙+溶液B→溶液E+氢气,可知固体乙只能是
本题解析:
本题难度:一般
|