微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ( 6 分)回答下列问题:
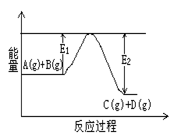
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0 (填“>”、“<”、“无法确定”)。
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0 (填“>”、“<”、“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +" 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2生成气态CO和气态H2 O的热化学方程式为 。
O的热化学方程式为 。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧 化剂液态双氧水(H2O2)。
化剂液态双氧水(H2O2)。
当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ
的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为
。
参考答案:(6分) (1) <
本题解析:略
本题难度:一般
2、选择题 下列叙述中正确的是
A.离子化合物熔融状态下一定导电
B.金属元素跟非金属元素化合时都能形成离子键
C.离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素
D.离子化合物中不一定含有离子键,含共价键的化合物不一定是共价化合物
参考答案:A
本题解析:
试题分析:A、离子化合物熔融状态下能够电离出离子,一定导电,A正确;B、金属元素跟非金属元素化合时不一定都能形成离子键,例如氯化铝中含有共价键,B不正确;C、离子化合物中的阳离子不一定只是金属离子,也可能是铵根离子。酸根离子中也可能含有金属元素,例如偏铝酸钠等,C不正确;D、离子化合物中一定含有离子键,含共价键的化合物不一定是共价化合物,D不正确,答案选A。
本题难度:简单
3、选择题 下列与化学反应能量变化相关的叙述不正确的是
A.化学反应是旧键断裂和新键形成的过程
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
参考答案:B
本题解析:
试题分析:化学反应要生成新物质就要有旧键的断裂和新键的形成,A对。不选;反应速率与反应的热效应无关,B错,选B;反应的焓变与反应的途径无关,故应用盖斯定律,可计算某些难以直接测量的反应焓变,C对,不选;反应的焓变与反应的条件无关,D对,不选。选B。
考点:化学反应的实质、反应的焓变和盖斯定律。
本题难度:一般
4、选择题 在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
A.S(s) + O2 (g) =SO2(g); △H1 S(g) + O2 (g) =SO2(g);△H2
B.2H2(g) + O2 (g)= 2H2O(g);△H1 2H2 (g) + O2 (g) = 2H2O(l);△H2
C.CO(g) + 1/2 O2(g) = CO2(g);△H1 2CO(g) + O2(g) = 2CO2 (g);△H2
D.H2 (g) +Cl2(g)=2HCl(g);△H1 1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H2
参考答案:D
本题解析:
试题分析:A、S(s)完全燃烧比S(g)完全燃烧放出的热量少,所以△H1 >△H2,错误;B、氢气完全燃烧生液态水需要吸收热量才能转化为水蒸气,所以等量的氢气完全燃烧生成水蒸气放出的热量多,△H1 >△H2,错误;C、CO的量越多,完全燃烧生成二氧化碳气体放出的热量越多,所以△H1 >△H2,错误;D、氢气的量越多,生成HCl(g)放出的热量越多,所以△H2>△H1,正确,答案选D。
考点:考查化学反应热效应的比较
本题难度:一般
5、选择题 下列物质既含有离子键,又含有共价键的是(??)
A.H2
B.NaOH
C.MgCl2
D.HCl
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,加成可知,A~D中含有的化学键分别是非极性键、离子键和极性键、离子键、极性键。所以答案选B。
本题难度:一般