0.193
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤?????????、?????????。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为?????????。
参考答案:(1)烧杯、100mL的容量瓶、胶头滴管?????????(
本题解析:
试题分析:1、配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,
2、由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
3、Mn2+与ClO-反应生成了MnO2沉淀H+和 Cl-。
Fe2+在酸性条件下被ClO-氧化为Fe3+、Cl-和 H2O。
4、取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
5、观察图表可以知道两种物质随着温度的升高溶解度一种增大一种减小,可以利用溶解度的不同来分离。
6、根据元素守恒可以计算出硼镁泥中镁的质量,在计算出196.8 g MgSO4·7H2O中镁的质量就可以计算出其产率了。
点评:本题属于简单题,难度不大,但是知识点较多,做题时先分析图表,了解每一步的设计作用,再进行做题。
本题难度:一般
2、选择题 用MnO2,NaCl,KClO3,C2H5OH,HCOOH,浓H2S4等为原料不能制得下列气体中①Cl2;②H2S;③HCl;④C2H4;⑤CO;⑥C2H2;⑦O2的??????????????????????????????????????????? [??? ]
A.①③
B.②⑥
C.④⑤
D.③⑦
参考答案:B
本题解析:可制Cl2:4H2SO4+4NaCl+MnO2=4NaHSO4+MnCl2+Cl2↑+2H2O
可制HCl:H2SO4+NaCl=NaHSO4+HCl↑
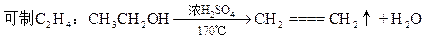
可制CO:HCOOH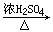 H2O+CO↑ H2O+CO↑
可制O2:2KClO3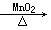 2KCl+3O2↑ 2KCl+3O2↑
H2S,C2H2不可制得,制H2S需FeS(或其他硫化物)与稀H2SO4;制C2H2需CaC2和水。
本题难度:一般
3、简答题 (14分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
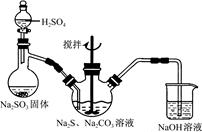 ????? ?????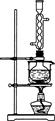
图1????????????????????????????????图2
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有??????????
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na2S2O3+I2 = 2NaI+Na2S4O6
①利用KIO3、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式?????????????????????????????。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有?????????。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待???????????????????????时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na2S·9H2O晶体。
参考答案:(14分)(1)吸收二氧化硫等尾气,防止污染空气 (2分)?
本题解析:
试题分析:(1)图1所示装置中有二氧化硫参与反应,所以氢氧化钠的作用是吸收二氧化硫等尾气,防止污染空气;如将分液漏斗中的H2SO4改成浓盐酸,浓盐酸易挥发,与三颈烧瓶内的物质反应生成NaCl,所以三颈烧瓶内除Na2S2O3生成外,还有NaCl杂质生成;
(2)①KIO3、KI和HCl作原料可配制标准碘溶液,说明产物中有单质碘生成,所以化学方程式的元素守恒规律可写出该反应的离子方程式为IO3-+5I-+6 H+=3I2+ 3H2O;
②因为碘遇淀粉变蓝色,所以选择淀粉作指示剂;滴定时Na2S2O3·5H2O样品溶液放于锥形瓶中,则标准碘溶液应放在酸式滴定管中;不能用碱式滴定管盛放碘溶液,因为碘单质有一定的氧化性,容易腐蚀碱式滴定管的胶管部分;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则所用标准碘液偏少,造成Na2S2O3·5H2O的质量分数偏低;
(3)③根据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精的特点,判断待烧瓶中固体不再减少时停止加热;
④杂质不溶于酒精,所以趁热过滤可除去杂质;
⑤Na2S在低温时在酒精中的溶解度减小,所以将过滤后的滤液冷却结晶,再过滤可得晶体样品。
本题难度:一般
4、填空题 某研究性学习小组对氨气制法和性质进行如下设计:
⑴下面是该小组同学提出实验室制备氨气的几种方案
A.硝酸铵固体和氢氧化钙固体混合加热
B.加热氯化铵固体
C.氯化铵固体和氢氧化钙固体混合加热
D.将浓硫酸滴入浓氨水中
你认为可行的是?????(填字母,多选不给分),
该反应的化学方程式?????????????????????????????
⑵该小组同学把1 mol O2和NH3的混合气体导入密闭容器中,在催化剂的作用下加热,使之充分反应,恢复到常温常压下。若整个容器中的反应随着氧气的量的增加而发生如下两个反应:
4NH3 + 5O2  ?4NO + 6H20;4NO + 3O2 + 2H2O = 4HNO3设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液。 ?4NO + 6H20;4NO + 3O2 + 2H2O = 4HNO3设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液。
①向溶液中滴入酚酞,溶液呈红色,y = ?????????(用x的代数式表示,下同)
x的取值范围??????????????????????????,
②容器中有不溶与水的气体,此气体在空气中变为红棕色,向溶液中滴入石蕊,溶液呈红色,y = ???????????????,x的取值范围????????????????
参考答案:⑴C ??2NH4Cl + Ca(OH)2=aCl2 + 2
本题解析:略
本题难度:简单
5、实验题 电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:

用电石浆可生产无水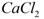 ,某化工厂设计了以下工艺流程: ,某化工厂设计了以下工艺流程:
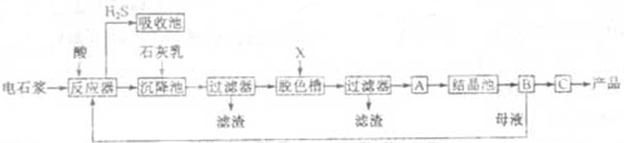
已知氯化钙晶体的化学式是: 是一种酸性气体,且具有还原性。 是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用 ????。
(2)脱色槽中应加入的物质X是???;设备A的作用是??;设备B的名称为 ?④ ?;设备C的作用是 ??⑤?。
(3)为了满足环保要求,需将废气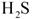 通入吸收池,下列物质中最适合作为吸收剂的是?⑥?。 通入吸收池,下列物质中最适合作为吸收剂的是?⑥?。
A.水
B.浓硫酸
C.石灰乳
D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是?⑦?????。
参考答案:①盐酸
②活性炭
③蒸发浓缩
④
本题解析:实验目的是用电石浆可生产无水CaCl2。所以在反应器中加的酸必为盐酸,此时反应器中是CaCl2、AlCl3、FeCl3、MgCl2溶液,加石灰乳将产生沉淀,氢氧化铁、氢氧化铝、氢氧化镁,过滤除去铁元素、镁元素、铝元素;过滤后所得溶液主要为氯化钙溶液,再经过脱色、过滤处理得到氯化钙溶液,经过蒸发结晶、过滤、脱水干燥得到无水氯化钙产品。
(1)实验目的是用电石浆可生产无水CaCl2。所以在反应器中加的酸必为盐酸;
(2)加活性炭进行脱色处理,过滤处理得到氯化钙溶液,经过蒸发结晶、过滤、脱水干燥得到无水氯化钙产品。
(3)硫化氢气体用碱液吸收,环保,同时石灰乳易得、经济。
(4)将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益;
本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握。
本题难度:一般
|