微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
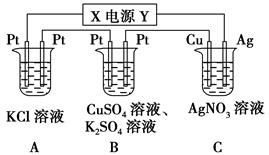
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为________(设电解前后溶液体积无变化)。
参考答案:(1)负极 (2)增大 减小 不变 (3)0.025 mol
本题解析:
试题分析:(1)C装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极。(2)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大,B装置中阴极上先析出铜,当铜离子消耗完后将析出氢气,而阳极上析出氧气,溶液中氢离子浓度增大,C装置中阴极析出银单质,阳极上的银失去电子变成银离子,理论上AgNO3溶液的物质的量浓度不变。(3)B装置两极上电子转移的数目与C装置中转移的电子数目相同,C装置中转移的电子为
本题难度:一般
2、填空题 某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:

已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是????????。(写化学式)
(2)写出第③步反应的离子方程式???????????。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有?????????????。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:

电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比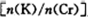 为d,则此时的铬酸钾的转化率为?????????。
为d,则此时的铬酸钾的转化率为?????????。
参考答案:(1)Cr(OH)3、Fe(OH)3、Cu(OH)2(3分)
本题解析:
试题分析:(1)由题干所给信息可知在pH=8.0~9.5时,Cr3+、Fe3+、Cu2+均转化为相应氢氧化物沉淀,因此利用流程可知滤渣的成分为Cr(OH)3、Fe(OH)3、Cu(OH)2。(2)在第③步中+3价Cr被氧化为+6价Cr,因此H2O2被还原,结合溶液为碱性和电荷守恒等可写出反应的离子方程式。(3)调节pH=13时,Cr(OH)3溶解,而Fe(OH)3、Cu(OH)2仍为固体,因此可通过过滤操作分离出[Cr(OH)4]-,过滤操作所需玻璃仪器有玻璃棒、烧杯、漏斗。(4)由电解图示知电解
本题难度:困难
3、选择题 现有用离子交换膜和石墨作电极的电解槽,电解饱和Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是

A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4溶液由G处加入,F处加入稀硫酸[
D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氧气
参考答案:B
本题解析:略
本题难度:一般
4、选择题 用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )
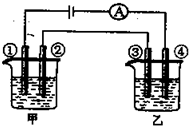
| A | B | C | D
甲
KOH
H2SO4
Na2SO4
CuSO4
乙
CuSO4
AgNO3
HCl
HNO3
A.A
B.B
C.C
D.D
参考答案:A、甲池中,电解氢氧化钾的实质是电解水,碱性增强,pH增大,
本题解析:
本题难度:简单
5、填空题 (10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。
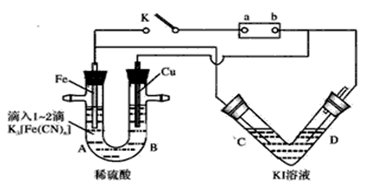
(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为 (填“a”或“b”).Fe电极上发生的电极反应为 。
(2)断开K电键,V形管中为将 能转化为 能的装置;U形管A端现象为 。
参考答案:(1)b;2H++2e-=H2↑(2)电能;化学能;产生蓝色
本题解析:
试题分析:(1)开始时,接通K电键:U形管中无沉淀,说明溶液中为生成亚铁离子,则铁为电解池的阴极,则电源的正极为b;铁为阴极,电极反应为:2H++2e-=H2↑;(2)断开K电键,左侧形成原电池,V形管中为电解池,是将电能转化为化学能,铁为原电池的负极,失去电子变成亚铁离子,铁氰化钾(K3[Fe(CN)6])遇Fe2+产生蓝色沉淀。
考点:原电池和电解池的原理。
本题难度:困难
|