微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.HClO见光会分解,故氯水保存在棕色试剂瓶中
D.Fe在Cl2中燃烧生成FeCl3,故在和盐酸反应中Fe也显+3价
参考答案:C
本题解析:
正确答案:C
A.不正确,SO2可作漂白剂是因为SO2能与某些有机有色物质反应生成不稳定的无色物质。
B.不正确,Na的金属活性比Mg强,但Na与MgCl2溶液反应时,先与水反应
C.正确,HClO见光会分解,故氯水保存在棕色试剂瓶中
D.不正确,Fe在Cl2中燃烧生成FeCl3,但在和盐酸反应中Fe显+2价
本题难度:简单
2、选择题 对于反应H-+NH3?=?H2?+?NH2-的说法正确的是????????????????????????????? [???? ]
A、该反应属于置换反应????????????
B、NH3是还原剂
C、NH2-是还原产物?????????????????
D、H2既是氧化产物又是还原产物
参考答案:D
本题解析:
本题难度:简单
3、选择题 某含铬Cr2O72-废水用硫酸亚铁铵[F eSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是(???)
eSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是(???)
A.在FeO·FeyCrxO3中3x=y
B.处理废水中Cr2O72-的物质的量为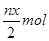
C.反应中发生转移的电子数为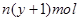
D.消耗硫酸亚铁铵的物质的量为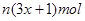
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (6分)21.6g氧化铁和铁粉的混合物恰好溶于100mL某浓度的稀硫酸中。并无气体放出。向反应后的溶液中滴加硫氰化钾溶液,不显红色。求:
(1)原混合物中铁粉的质量。
(2)稀硫酸的物质的量浓度。
参考答案:(1)5.6g??(2)3mol/L
本题解析:
试题分析:由题意可知,氧化铁与铁粉恰好完全反应,都没有剩余,而Fe2O3 + Fe ="=" 3FeO,故二者物质的量之比为1∶1 ,设各有Xmol,则有160X+56X=21.6,解得X=0.1mol,铁粉的质量m="56g/mol" × 0.1mol =5.6g。反应生成0.3molFeO,恰好溶于100mL某浓度的稀硫酸中,FeO + H2SO4 ="=" FeSO4 + H2O ,故稀硫酸的物质的量浓度n= 0.3mol / 100mL = 0.3mol / 0.1L = 3mol/L。?
本题难度:一般
5、选择题 化工厂经常用浓氨水检验管道是否漏氯气,其化学反应方程式为:3Cl2+8NH3=6NH4Cl+N2,该反应的氧化剂是??

???,还原剂是????????,氧化剂与还原剂的物质的量之比为????????。
参考答案:Cl2, NH3, 3∶2
本题解析:氧化还原反应中有元素化合价升高的物质发生氧化反应,本身做还原剂,有元素化合价降低的物质发生还原反应,本身做氧化剂。在该反应中氧化剂和还原剂分别是Cl2和NH3。需注意的是8mol NH3中只有2mol中氮元素的化合价升高,故氧化剂和还原剂的物质的量之比为3:2。
本题难度:简单