微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝热反应”的化学方程式为:2Al+ Fe2O3 Al2O3+ 2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”.“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下
Al2O3+ 2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”.“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下

(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是:________________________________
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_________________,当观察到__________现象时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的_____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
2、填空题 以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
?I.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
V.煅烧FeCO3,得到Fe2O3固体。 已知:NH4HCO3在热水中分解。
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是___________________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用___________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是____________________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是__________________________。
(5)已知煅烧FeCO3的化学方程式是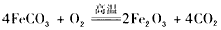 现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中 Fe2O3的质量是______________ kg。(摩尔质量/g/mol:FeCO3 116 Fe2O3 160 FeO 72)
现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中 Fe2O3的质量是______________ kg。(摩尔质量/g/mol:FeCO3 116 Fe2O3 160 FeO 72)
3、选择题 我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类和液化石油气(LPG)类.这两类燃料的主要成分是( )
A.醇类
B.一氧化碳
C.氢气
D.烃类
4、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下
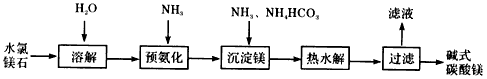
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为_____________。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
CO2 0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数_________(填“升高”、“降低”或“不变”)。
5、填空题 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al?2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:??
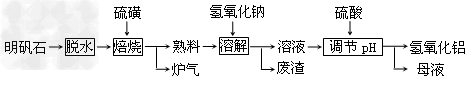
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S 2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
(2)“溶解”时反应的离子方程式为____________。
(3)“调节pH后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_____________。
(4)“母液”中可回收的物质是_____________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式为_______________。