微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式不正确的是
A.用惰性电极电解氯化钠溶液: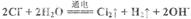
B.向FeBr2溶液中通入Cl2,使溶液中一半的Br-被氧化:
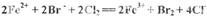
C.用双氧水和稀硫酸处理印刷电路板: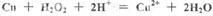
D.向碳酸氢钙溶液中加入足量的氢氧化钠溶液:
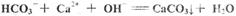
参考答案:D
本题解析:略
本题难度:一般
2、选择题 在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是(???? )
A.BaCl2+K2SO4=BaSO4↓+2KCl
B.BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
C.Ba(OH)2+ H2SO4=BaSO4↓+2H2O
D.Ba(OH)2+ 2KHSO4=BaSO4↓+K2SO4+2H2O
参考答案:A
本题解析:
试题分析:B不正确,因为碳酸钡是难溶性物质,用化学式表示;C中还有水生成,不正确;D中也是有水生成的,答案选A。
点评:由于离子方程式不但可以表示具体某个反应,还可以表示一类反应。因此该类型的试题需要逐一分析、排除才能得出正确的结论。
本题难度:一般
3、填空题
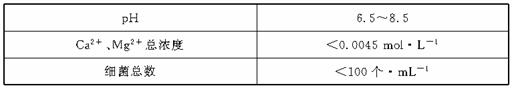
以下是原水处理成自来水的工艺流程示意图

(1)原水中含Ca2+、Mg2+、HCO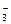 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
(2)凝聚剂除去悬浮固体颗粒的过程?????????????(填写编号,多选倒扣)
①只是物理过程?②只是化学过程?③是物理和化学过程FeSO4·7H2O是常用的凝聚剂,它在水中最终生成??????????????沉淀。
(3)通入二氧化碳的目的是??????????????????和??????????????????。
(4)气体A的作用是????????。这种作用是基于气体A和水反应的产物具有???????性。
(5)下列物质中,?????????????????可以作为气体A的代用品。(填写编号)
①Ca(ClO)2? ②浓氨水? ③K2FeO4? ④SO2
参考答案:(1)HCO 本题解析:(1)含Ca2+、Mg2+、HCO
本题解析:(1)含Ca2+、Mg2+、HCO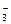 、Cl-的水中加入Ca(OH)2可发生多种反应:HCO
、Cl-的水中加入Ca(OH)2可发生多种反应:HCO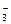 +OH-===CO
+OH-===CO
本题难度:简单
4、填空题 (10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:??????????????????????????????????????????
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为??????????????????
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为?????????????????????????????????
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为 ??????????????????????
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为???????????????
参考答案: 本题解析:
本题解析:
试题分析:Ⅰ.依据各类方程式书写的要求和题意要求书写,注意电荷守恒和方式式配平。
Ⅱ.(4)溶液的浓度可用质量分数和物质的量浓度两种不同的物理量来表示。溶液的质量为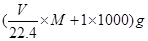 ,溶液的体积为
,溶液的体积为 本题难度:一般
本题难度:一般
5、填空题 Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。
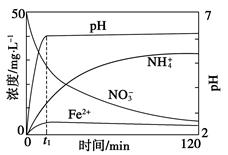
参考答案:Ⅰ.(1)2Fe3++2I-=2Fe2++I2
(2)
本题解析:(1)Fe3+能氧化I-,离子方程式为2Fe3++2I-=2Fe2++I2。
(2)Fe2+和SCN-不反应,当加入H2O2时,发生2Fe2++2H++H2O2=2Fe3++2H2O,然后Fe3+和SCN-反应生成血红色溶液,继续滴加H2O2,SCN-被氧化。根据反应③,当有1 mol N2生成时,转移电子的物质的量为11×2×[-1-(-2)] mol=22 mol。(注:根据氧化剂计算方便)
(3)根据(1)(2)中方程式可得还原性I->Fe2+>SCN-。(根据还原剂还原性大于还原产物还
本题难度:困难