微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据美国《科学》杂志报道,外?太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,方程式为CH2=CHOH→CH3CHO?+Q(Q﹥0)。据此,以下叙述中不正确的是 [???? ]
A.该星球表面温度很低
B.低温下稳定性:CH2=CHOH<CH3CHO
C.该星球表面温度很高
D.高温下稳定性:CH2=CHOH?>?CH3CHO
参考答案:A
本题解析:
本题难度:一般
2、选择题 对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是(??? )
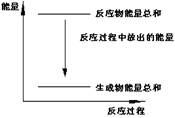
A.反应过程中能量关系可用上图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时,正极F放出气体一定为11.2L
参考答案:D
本题解析:根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应。而锌与稀硫酸的反应是就是放热反应,所以选项A正确。反应热和化学计量数有关系,B正确。该反应是氧化还原反应,所以能设计成原电池,C正确。32.5g锌失去32.5g÷65g/mol×2=1.0mol,所以生成氢气是0.5mol,但体积不一定是11.2L,选项D不正确,答案选D。
本题难度:一般
3、选择题 根据右图提供的信息,下列所得结论正确的是( )
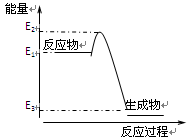
A.该反应是吸热反应
B.该反应的生成物比反应物稳定
C.该反应一定可以设计成为原电池
D.该反应向外界放出的热量为E2 - E3
参考答案:B
本题解析:依题意知反应物的能量大于生成物,放热反应。能量越低越稳定,A错误,B正确。
设计原电池要有自发的氧化还原反应,C错误。该反应向外界放出的热量为E1 - E3,D错误。
本题难度:一般
4、推断题 (14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
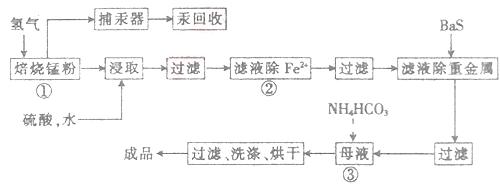
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:
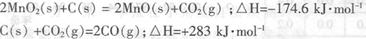
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55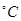 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
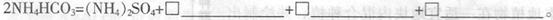
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
参考答案:28.(14分)(1)用电池外壳锌皮与硫酸作用生产硫酸锌时的
本题解析:
试题分析:(1)该流程中用硫酸浸取的时候可以生成氢气;(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;(4)将
Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,故需加入双氧水,还原为水,不引入新的杂质,控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,故需控制pH为3.7~8.6;(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应
本题难度:一般
5、选择题 将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
参考答案:B
本题解析:反应一发生即停止加热,反应仍可持续进行,这说明该反应是放热反应,即反应物的总能量高于生成物的总能量。所以正确的答案选B。
本题难度:简单