微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 我国能源以煤为主,燃煤产生的二氧化硫的年排放量为1825吨,居世界首位。二氧化硫在湿度较大的大气中,在烟尘中的金属离子作用下会发生催化氧化反应,形成酸雾,其化学方程式是__________________________________________________________。
参考答案:S+O2 本题解析:煤中有单质硫,硫在燃烧时生成二氧化硫。二氧化硫中硫元素化合价是+4价,处于中间价态,当其继续催化氧化时,显然硫元素要升高价态,生成含+6价硫的三氧化硫。酸雾应是酸的小液滴,三氧化硫是酸性氧化物,不是酸,所以还应有三氧化硫与水生成硫酸的反应。
本题解析:煤中有单质硫,硫在燃烧时生成二氧化硫。二氧化硫中硫元素化合价是+4价,处于中间价态,当其继续催化氧化时,显然硫元素要升高价态,生成含+6价硫的三氧化硫。酸雾应是酸的小液滴,三氧化硫是酸性氧化物,不是酸,所以还应有三氧化硫与水生成硫酸的反应。
本题难度:简单
2、选择题 下列过程中需要吸收能量的是????????????????????????????????????????(????)
A.O2→2O
B.H2+Cl2→2HCl
C.Na2O+H2O="2NaOH"
D.2Cl→Cl2
参考答案:A
本题解析:略
本题难度:简单
3、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/°C
| 200
| 300
| 400
| 500
| 600
|
氨含量/%
| 89.9
| 71.0
| 47.0
| 26.4
| 13.8
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是???。
(2)根据-4,合成氨的热化学方程式是?????????????。

(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2? 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?????????;该温度下的平衡常数K=???????(用分数表示);俗使K增大,可以采取的措施是?????????????。 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=?????????;该温度下的平衡常数K=???????(用分数表示);俗使K增大,可以采取的措施是?????????????。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是??(选填序号字母)
a.及时分离出NH3???????????????????????????b.升高温度
c.增大压强???????????????????? d.使用催化剂
参考答案: 本题解析:略 本题解析:略
本题难度:一般
4、选择题 右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
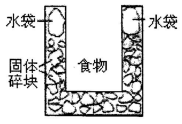
A.硝酸铵
B.生石灰
C.氯化镁
D.石灰石
参考答案:B
本题解析:
试题分析:水与固体碎块混和,杯内食物温度逐渐上升,这说明和水的混合过程是放热的。则选项B正确,A中是吸热的,C中热量不明显,D中不溶于水,答案选B。
点评:该题是基础性试题的考查,试题贴近生活实际,有利于调到学生的学习兴趣和学习积极性。该题基础性强,旨在考查学生灵活运用基础知识解决实际问题的能力,难度不大,记住常见的热量变化即可。
本题难度:一般
5、填空题 (1)已知热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。 O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
(2)明矾能净水的原因: (用离子方程式和必要的文字解释)
___________________________________________________________________________。
(3)已知FeCl3能水解 ,则配制FeCl3溶液的方法是 ____????????????????????????。
(4)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
铁锅的锈蚀是???????腐蚀(填“析氢”或“吸氧”)
写出铁锅腐蚀负极的电极反应式:???????????????????????????????
正极的电极反应式:???????????????????????????????
参考答案:(1)  本题解析: 本题解析:
试题分析:(1)根据反应的热化学方程式可知,该反应是吸热反应,所以反应物的总能量低于生成物的总能量,则图像是(见答案)。
(2)因为明矾溶于水电离出的铝离子发生水解反应,Al3++3H2O Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。 Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
(3)Fe
本题难度:一般
|