微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻。然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
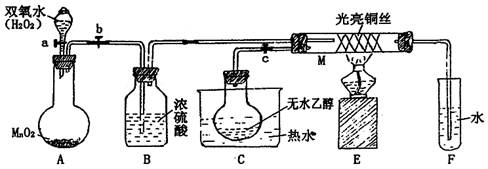
(1) A中发生反应的化学方程式:??????????????????????????????????????,
B的作用:??????????????;C中热水的作用:??????????????????????????。
(2) M处发生反应的化学方程式为:?????????????????????????????????????。
(3) M管中可观察到的现象:???????????????????????????????????????????,从中可认识到该实验过程中催化剂???????(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的????????。
(4) 验证乙醇氧化产物的试剂是?????,并写出对应的化学方程式???????????????。
(5) 若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有????????,要除去该物质,可先在混合液中加入????????(填写字母)。
a、氯化钠溶液????? b、苯???? c、碳酸氢钠溶液???? d、四氯化碳
参考答案:
 本题解析:略
本题解析:略
本题难度:简单
2、简答题 实验室常用的几种气体发生装置如图A、B、C所示:
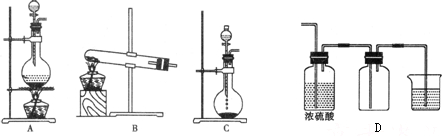
(1)实验室可以用B或C装置制取氧气,如果用C装置,通常使用的药品是______.检查C装置气密性是否良好的操作方法是______.
(2)气体的性质是气体收集方法选择的主要依据.下列性质与收集方法无关的是______(填序号).
①密度②颜色③溶解性④与氧气反应
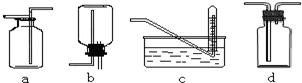
(3)图是某学生设计收集气体的几种装置,其中收集氧气不可行的是______(填写仪器代号).
(4)若用C装置与D装置相连制取并收集X气体,则X可能是下列气体中的______(填写序号)
①CO2?????②NO?????③Cl2?????④H2.
参考答案:(1)实验室制取氧气常用高锰酸钾或氯酸钾与二氧化锰在加热条件
本题解析:
本题难度:一般
3、选择题 在配制100mL 2mol/L的NaOH溶液时,下列操作会导致结果偏低的是(?? )
(1)用拖盘天平称量时砝码放在左盘
(2)溶解NaOH固体后没有冷却至室温就向容量瓶转移溶液
(3)将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
(4)定容时俯视刻度线
(5)定容时仰视刻度线
(6)干净的容量瓶未经干燥就用于配制溶液
A.(2)(4)(6)
B.(1)(3)(4)
C.(1)(3)(5)
D.(2)(3)(4)
参考答案:C
本题解析:略
本题难度:简单
4、选择题 检验Cl2是否充满了集气瓶的正确操作为 [???? ]
A.用玻璃棒粘上湿润的碘化钾淀粉试纸伸到集气瓶口附近,观察试纸是否变蓝
B.将AgNO3溶液滴入集气瓶中.观察有无白色沉淀生成
C.用玻璃棒蘸取少许NaOH溶液放人集气瓶口附近,看是否反应
D.用手将湿润的碘化钾淀粉试纸放在集气瓶口上方,观察颜色是否变蓝
参考答案:A
本题解析:
本题难度:简单
5、实验题 硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:
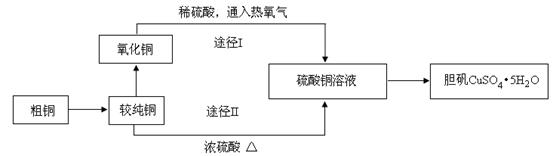
(1)“较纯铜”转化为氧化铜时,应将其置于??????????内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是?????????????????????。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是??????????。
a.灼烧过程中部分氧化铜被还原?????????b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜???????d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、???????、冷却结晶、????????、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① ??????????????? ??????????????????。
②??????????????????????????????????????????????????????????。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥?
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
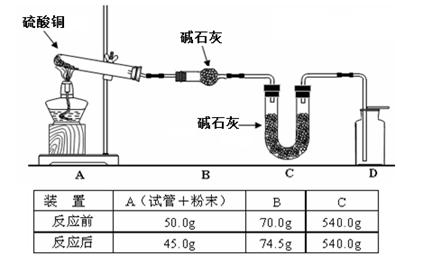
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:??????????????????。
参考答案:(1)坩埚;油脂在碱性条件下发生水解而除去 (2分,各1分)
本题解析:
试题分析:(1)进行灼烧所需的温度较高应选择坩埚,“粗铜”表面的油脂可以用热碱溶液洗去,原因是油脂在碱性条件下发生水解而除去。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是a.灼烧过程中部分氧化铜被还原 d.灼烧不充分铜未被完全氧化。
(2)过滤完后还要进行蒸发浓缩然后冷却结晶、过滤洗涤,最后再自然干燥。途径Ⅰ有明显的两个优点:①对照反应转化情况可知产生等量胆矾,途径I消耗硫酸少;②途径I不产生污染大气的气体。
(3)测定的相对误差大于零说明水的量较多或固体的质量较少,a.加热后容器未放入干燥器中冷却不一定产生误差;b.最后两次加热后的质量相差较大也可能会使水的质量减小; c.加热前称量时容器未完全干燥,会有水将会使水的量增多,正确;d.加热过程中有少量溅失,将会使剩下的固体质量减少,相当于水的量增多,正确;
(4)加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃,说明有氧气生成。由记录的数据可得出生成酸性气体质量是4.5g,生成氧气是0.5g,生成固体物质45g,根据电子守恒,由生成氧气0.5g,失电子数(0.5/32)*4mol。得电子可能是生成了二氧化硫,即生成二氧化硫的量为:(0.5/32)*2mol,质量为2g,还有酸性气体应该是三氧化硫,质量为2.5g,物质的量为2.5/80mol,即物质的量之比:二氧化硫:三氧化硫:氧气=2:2:1,根据原子守恒可知生成黑色固体为氧化铜,化学方程式为 。
。
本题难度:困难