微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法
该法的工艺流程为:CrO42-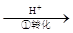 Cr2O72-
Cr2O72-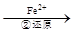 Cr3+
Cr3+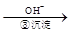 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+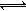 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是??????????????。
A. Cr2O72-和CrO42-的浓度相同?? B. 2v(Cr2O72-)=v(CrO42-)? C.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要?????????mol的FeSO4·7H2O。
写出第②步中反应的离子方程式____________________________________。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)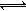 Cr3+(aq)+3OH―(aq)
Cr3+(aq)+3OH―(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?????????????。
参考答案:.(1) 橙色?? (2)C??? (3)6????? Cr
本题解析:(1)若该平衡处在强酸性环境,则平衡向正反应方向移动,溶液显橙色。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以C正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,A不正确;反应速率之比是相应的化学计量数之比,所以B中始终是满足的,答案选C。
(3)1 mol Cr2O72-离子得到6mol电子,根据电子的得失守恒可知,需要6molFeSO4·7H2O。
根据反应物和生成物可知,反应的方程式为Cr2O72-+6Fe2++14H+ =6Fe3++2Cr3++7 H2O。
(4)c(Cr3+)=10-5mol/L时,根据溶度积常数表达式可知,c(OH―)=10-9mol/L,则氢离子浓度是10-5mol/L,所以pH=5。
本题难度:一般
2、选择题 某温度下,C和H2O(气)在密闭容器中发生下列反应:
C(固)+H2O(气) 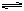 CO(气)+H2(气);? CO(气)+H2O(气)
CO(气)+H2(气);? CO(气)+H2O(气) 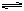 CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为(??)
CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为(??)
A.0.1mol/L
B.0.9mol/L
C.1.8mol/L
D.1.9mol/L
参考答案:B
本题解析:设CO2的浓度为x,则在第二个反应中消耗CO是x,同时生成氢气也是x。则根据第一个反应可知1.9mol/L-x-x=0.1mol/L,解得x=0.9mol/L,答案选B。
本题难度:一般
3、选择题 反应2SO2+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol·L-1·s-1,则这段时间为 [???? ]
2SO3(g)经一段时间后,SO3的浓度增加了0.4?mol/L,在这段时间内用O2表示的反应速率为0.04?mol·L-1·s-1,则这段时间为 [???? ]
A.??0.1?s ????????
B.??2.5?s ?? ?
C.??5?s ??
D.??10?s
参考答案:C
本题解析:
本题难度:简单
4、填空题 已知NO2和N2O4可以相互转化: N2O4  ?2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
?2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为????????????mol/L·s
(2)在4s时容器内的压强为开始时的???????????倍
(3)在平衡时容器内含N2O4????????????????mol
(4)在平衡时容器内NO2的浓度为???????????mol/L
(5)平衡时N2O4的转化率为??????????
参考答案:(1)0.005mol/(L·s)(2)1.2倍(3)0.2
本题解析:
试题分析:N2O4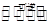 2 NO2
2 NO2
(1)反应进行4s时NO2的浓度为0.04mol/L;则v(NO2)="0.04mol/L" / 4s="0.04mol/(L·s)" ;v(N2O4)/v(NO2)=1/2,故前4秒以N2O4浓度变化表示的平均反应速率为0.005mol/(L·s)
(2)等温等容,压强与气体的物质的量成正比。则4秒时,n(NO2)="0.04mol/L" * 10L = 0.4mol
参加反应的N2O4为0.2mol,则此时容器内气体总物质的量为1mol-0.2mol+0.4mol=1.2mol,起始是容器中只有1mol N2O4气体,则在4s时容器内的压强为开始时的1.2倍;
(3)平衡时压强为开始的1.8倍,则平衡时容器内气体物质的量为1.8mol,设参加反应的N2O4为x,则有(1-x)+2x=1.8?解得:x=0.8mol,则在平衡时容器内含N2O4?的物质的量为:1mol-0.8mol=0.2mol;
(4)由于在平衡时容器内含N2O4?0.8mol,故此时容器内NO2的浓度为(0.8*2)/10 mol/L =0.16mol/L,则在平衡时容器内NO2的浓度为0.16mol/L;
(5)平衡时消耗的N2O4物质的量为:0.8mol ,则平衡时N2O4的转化率为:0.8mol/1mol=80% ;
点评:化学反应速率为高考重要考点之一,基础演算能力的要求较高,而且全面要求考生对可逆反应、化学反应速率等相关知识的理解与熟练掌握,具有一定的分析力度与考查难度,考生平时应当多注重化学反应速率相关内容的实践练习。
本题难度:一般
5、选择题 合成氨反应为N2+3H2 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
A.恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
B.恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
C.恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
D.恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
参考答案:C
本题解析:
试题分析:操作1中N2和操作2中NH3转化率之和为1的是(起始体积相同)等效平衡,C不是等效平衡。故选C。
本题难度:一般