微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,能被浓硝酸钝化的金属是
A.Mg
B.Fe
C.Cu
D.Al
参考答案:BD
本题解析:试题分析:常温下,能被浓硝酸钝化的金属是铁和铝,答案选BD。
考点:考查钝化的有关判断
点评:该题是基础性试题的考查,难度不大,有助于调动学生的学习兴趣和学习积极性,记住即可。
本题难度:一般
2、选择题 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入150mL一定浓度的NaOH溶液恰好沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中不正确的是
A.所用的NaOH溶液的物质的量浓度为3mol?L-1
B.当金属全部溶解时,收集到NO气体的体积一定为3.36L
C.参加反应的金属的总质量(m)为5.4g<m<14.4g
D.若将产生的气体全部转化为硝酸,则至少需要标况下2.52L的氧气
参考答案:AB
本题解析:分析:本题涉及到的反应有:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3.
将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入15mL一定浓度的NaOH溶液恰好沉淀完全,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为 =0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为
=0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为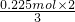 =0.15mol.
=0.15mol.
A、加入的氢氧化钠可能中和为反应的硝酸;
B、根据电子转移守恒计算NO物质的量,结合气体不一定是标准状况判断;
C、镁和铜的总的物质的量为0.225mol,利用极限法假定全为镁、全为铜计算判断;
D、根据4NO+3O2+2H2O=4HNO3计算判断.
解答:本题涉及到的反应有:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3.
将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入15mL一定浓度的NaOH溶液恰好沉淀完全,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加7.65g,则氢氧化镁和氢氧化铜含有氢氧根的质量为7.65g,氢氧根的物质的量为 =0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为
=0.45mol,则镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为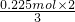 =0.15mol.
=0.15mol.
A、若硝酸无剩余,则氢氧化钠的物质的量等于0.45mol,氢氧化钠溶液的浓度为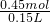 =3mol/L,硝酸可能有剩余,如剩余则氢氧化钠溶液的浓度大于3mol/L,故A错误;
=3mol/L,硝酸可能有剩余,如剩余则氢氧化钠溶液的浓度大于3mol/L,故A错误;
B、镁和铜的总的物质的量为0.225mol,根据电子转移守恒可知生成的NO物质的量为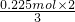 =0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故B错误;
=0.15mol,若为标准状况下,生成NO的体积为0.15mol×22.4L/mol=3.36L,但NO不一定处于标准状况,故B错误;
C、镁和铜的总的物质的量为0.225mol,假定全为镁,质量为0.225mol×24g/mol=5.4g,若全为铜,质量为0.225mol×64g/mol=14.4g,所以参加反应的金属的总质量(m)为5.4g<m<14.4g,故C正确;
D、根据电子转移守恒可知生成的NO物质的量为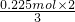 =0.15mol,由4NO+3O2+2H2O=4HNO3可知,至少需要氧气的物质的量为0.15mol×
=0.15mol,由4NO+3O2+2H2O=4HNO3可知,至少需要氧气的物质的量为0.15mol×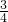 ,需标准状况下氧气体积为0.15mol×
,需标准状况下氧气体积为0.15mol×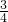 ×22.4L/mol=2.52L,故D正确.
×22.4L/mol=2.52L,故D正确.
故选AB.
点评:本题结合镁铜与硝酸反应、生成的盐与氢氧化钠反应,综合考查学生的得失电子守恒、质量守恒的综合计算能力,同时也考查了学生的学习综合运用和解决复杂问题的能力,是一道考查能力的好题,难度较大.
本题难度:困难
3、选择题 把7.4g?Na2CO3?10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═0.6mol?L-1.若把等质量的固体混合物加热至恒重,残留固体的质量是
A.3.18g
B.2.12g
C.4.22g
D.5.28g
参考答案:A
本题解析:分析:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体的物质的量,进而计算质量.
解答:固体混合物加热至恒重时,剩余固体为Na2CO3,
100mL溶液,其中c(Na+)═0.6mol?L-1.
则n(Na+)═0.1L×0.6mol?L-1=0.06mol,
n(Na2CO3)=0.03mol,
m(Na2CO3)=0.03mol×106g/mol=3.18g,
故选A.
点评:本题考查混合物的计算,题目难度不大,注意加热后剩余固体的成分,根据质量守恒计算.
本题难度:简单
4、选择题 下列物质中,不能用玻璃瓶来盛装的是
A.烧碱溶液
B.浓硫酸
C.氢氟酸
D.碳酸钠溶液
参考答案:C
本题解析:HF的特性是能和玻璃反应,NaOH溶液常温下和玻璃反应不明显.
本题难度:一般
5、选择题 将100?mL某未知浓度的AlCl3溶液分别加到600?mL?0.1?mol·L-1的NaOH溶液或600?mL?0.3?mol·L-1的NaOH溶液中,均能得到1.56?g?Al(OH)3沉淀。则此AlCl3溶液的浓度可能是
A.1 mol·L-1
B.0.5 mol·L-1
C.0.6 mol·L-1
D.0.4 mol·L-1
参考答案:B
本题解析:
本题难度:一般