微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 研究碳、氮、硫氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有________(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式:_____________________,用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+ 3/2O2(g)=CO2(g)+2H2O(g) △H=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式:_____________________。
(3)硫酸工业生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)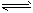 2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
2SO3(g),平衡体系中SO3的百分含量和温度的关系如下图所示。
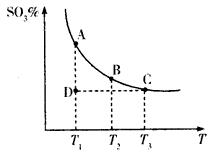
根据图示回答下列问题:
①2SO2(g)+O2(g)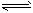 2SO3(g)的△H___0(填“>”或“<”)。
2SO3(g)的△H___0(填“>”或“<”)。
②若温度为T1、T2时,反应的化学平衡常数分别为K1、K2,则K1___K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正_____v逆。
参考答案:(1)acd
(2)CO+2H2=CH3OH;2CH
本题解析:
本题难度:一般
2、选择题 合成氨工业对国民经济和社会发展具有重要的意义对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g)673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示,下列叙述正确的是
2NH3(g)673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示,下列叙述正确的是
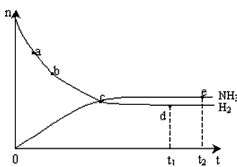 [???? ]
[???? ]
A 点a的下反应速率比点b的大
B 点c处反应达到平衡
C 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D 其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
参考答案:AD
本题解析:
本题难度:一般
3、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)?+?H2O(g)? CO2(g)?+?H2(g)的平衡常数随温度的变化如下表:
CO2(g)?+?H2(g)的平衡常数随温度的变化如下表:

试回答下列问题
(1)上述反应的正反应是__________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_____________(选填A、B、C、D)。

(4)830℃时,在2?L的密闭容器中加入4?mol?CO(g)和6?mol?H2O(g)达到平衡时,CO的转化率是_______________。
参考答案:(1)放热????
(2)增大;增大???
(3
本题解析:
本题难度:一般
4、选择题 现向一密闭容器中充入1molN2和3molH2,在一定条件下发生如下反应:N2+3H2?2NH3,下列有关说法错误的是( )
A.若加入催化剂,可以使反应速率加快
B.若减小压强,可以使反应速率减慢
C.反应达到平衡后,有2molNH3生成
D.反应达到平衡后,各物质的物质的量浓度不再发生变化
参考答案:A.催化剂降低反应的活化能,反应速率加快,故A正确;
本题解析:
本题难度:一般
5、选择题 已知N2+3H2?2NH3△H<O,反应速率为V1;2HI?H2+I2△H>O,反应速率为V2.对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为( )
A.同时增大
B.同时减小
C.V1增大,V2减小
D.V1减小,V2增大
参考答案:无论化学反应是放热反应还是吸热反应,只要升高温度,化学反应速
本题解析:
本题难度:简单