微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期且的。下列判断错误的是
A.废水处理时铝单质转化为Al3+
B.废水处理中,亚硝酸盐被还原
C.处理过程中,OH一参与了反应
D.铝粉颗粒大小影响废水处理的速率
参考答案:A
本题解析:
试题分析:A、pH>12溶液显碱性,则废水处理时铝单质转化为AlO2-,A不正确;B、铝是金属,具有还原性,因此废水处理中,亚硝酸盐被还原,B正确;C、废水处理时铝单质转化为AlO2-,这说明处理过程中,OH一参与了反应,C正确;D、固体反应物的表面积越大反应速率越快,因此铝粉颗粒大小影响废水处理的速率,D正确,答案选A。
本题难度:一般
2、选择题 将11.2gFe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到40gFe (NO3)2和Fe(NO3)3的混合物,将该固体在密闭容器中高温加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为 ( )
A.2240mL B.4480mL C.3360mL D.1120mL
参考答案:B
本题解析:
试题解析:根据题意可知,红棕色气体为二氧化氮,即铁与浓硝酸反应时,铁失去电子,氮元素得到电子;在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B是亚铁失去电子,氮元素得电子;再A、B气体混合通入足量水中剩余气体一定为NO,设其物质的量为x,由得失电子守恒可知,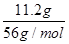 ×(3-0)=x×(5-2),x=0.2mol,即标准状况下体积为0.2mol×22.4L/mol=4480mL。
×(3-0)=x×(5-2),x=0.2mol,即标准状况下体积为0.2mol×22.4L/mol=4480mL。
考点:氧化还原反应的计算;硝酸的化学性质
本题难度:一般
3、选择题 在2Fe2++Cl2 = 2Fe3++2Cl-反应中,关于生成1molFe3+的说法正确的是
A.Fe2+失去电子的物质的量为2 mol
B.Cl2得电子的物质的量为1 mol
C.参加反应的Cl2的物质的量为1mol
D.氧化剂与还原剂的物质的量之比为1∶1
参考答案:B
本题解析:
试题分析:在2Fe2++Cl2 = 2Fe3++2Cl-反应中转移的电子为2e-,生成1molFe3+会转移电子1mol,A错;B 对;参加反应的Cl2的物质的量为0.5mol,C错;Cl2是氧化剂,Fe2+是还原剂,氧化剂与还原剂的物质的量之比为1∶2,D错,选B。
考点:氧化还原反应中有关电子的转移和物质的量的计算。
本题难度:一般
4、选择题 9.2g金属钠投入到足量的重水中,则产生的气体中含有( )
A.0.2mol中子
B.0.4mol电子
C.0.2mol质子
D.0.4mol分子
参考答案:B
本题解析:
本题难度:一般
5、选择题 实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①②
B.②④
C.①④
D.②③
参考答案:AD
本题解析:①Fe2O3中的铁为+3价,得到1mol电子对应的铁单质的质量为18.7g,MnO2中+4价Mn得到1mol电子对应的锰的质量为13.75g.故①正确;②MnO2中+4价Mn得到1mol电子,对应的锰的质量为13.75g,V2O5中+5价V得到1mol电子对应的质量为10.2g.故②错误;③Cr2O3中+3价的Cr得到1mol电子对应的质量为17.3g,V2O5中+5价V得到1mol电子对应的质量为10.2g.故③错误;④铝全部反应:Fe3O4中的铁为+2和+3价,1个氧离子可失去2个电子,从Fe3O4变成铁.当得到1mol电子时,Fe3O4失去0.5摩尔O,可以得到铁单质168g×0.5/4=21g,FeO中+2价Fe得到1mol电子对应的质量为28g,当铝为部分反应时④仍成立.故④正确;
本题难度:一般