微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
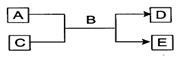
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,
则该反应的化学方程式为:?????????????????????????????,
检验D中阴离子所用试剂为:??????????????????????????????。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出C
溶液呈强碱性时反应的离子方程式:????????????????????????????。
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种):?????????????????,????????????????。
参考答案:(10分)(1)? Cl2 + SO2 + 2H2O = H
本题解析:
试题分析:B为自然界中含量最多的液体,则B是水。(1)如果A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,则A应该是氯气,C是SO2,反应的方程式是Cl2 + SO2 + 2H2O = H2SO4 + 2 HCl。相对分子质量E>D,所以E是硫酸,D是氯化氢。实验室检验氯离子的试剂是硝酸酸化的硝酸银。
(2)A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行,所以A是单质铝,和强碱反应的离子方程式是2Al + 2 OH- + 2H2O ="2Al" O
本题难度:一般
2、简答题 已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.
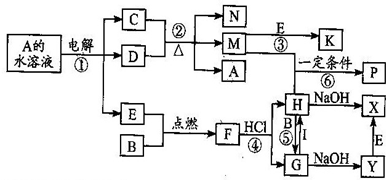
(1)B元素在周期表的位置:______,
(2)物质I的电子式:______.
(3)Y转变为X的现象是:______.涉及的反应方程式为:______.
(4)写出反应④的化学反应方程式:______.物质F与HI水溶液的离子反应方程式?式:______.
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质______.
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:______.
参考答案:A为硫酸盐,电解硫酸盐溶液,阳极上生成氧气E,阴极上析出金属
本题解析:
本题难度:一般
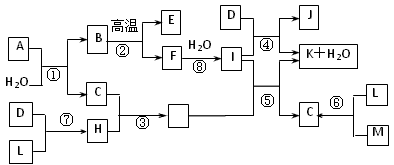
3、推断题 下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的结构式为__________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:_________________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为 ______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强 ③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,则a/b______1/2(选填“>”、“<”或“=”)。
参考答案:(1)O=C=O
(2)③⑧
(3)> <
本题解析:
本题难度:一般
4、填空题 (15分)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
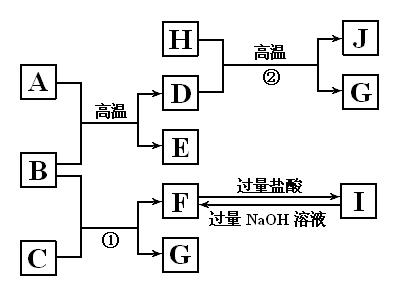
根据图示回答问题:
(1)写出下列物质的化学式:A ????????,E????????,I??????????;
(2)反应①的化学方程式是??????????????????????????????????????????;
反应②的化学方程式是??????????????????????????????????????????;
(3)J与盐酸反应的化学方程式是???????????????????????????????????;
反应后的溶液与D反应的化学方程式是??????????????????????????????????。
参考答案:
(1)Fe2O3; Al2O3; AlCl3
本题解析:因为B是地壳中含量最高的金属元素,即B为Al;J是磁性材料即J为Fe3O4。又D+H Fe3O4+G,且D是单质,G是气体单质,所以可以大胆推测D应为Fe,G为H2,H为H2O;因为A+Al
Fe3O4+G,且D是单质,G是气体单质,所以可以大胆推测D应为Fe,G为H2,H为H2O;因为A+Al 本题难度:一般
本题难度:一般
5、判断题 有一结晶水合物X·6H2O,其水溶液为浅绿色,可发生如下的转化(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,G为难溶于水的红褐色固体。在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀。
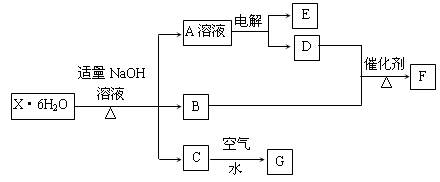
请回答下列问题:
⑴指出C→G的基本反应类型:_________反应。
⑵用惰性电极电解溶液A时得到E的电极反应式为____________________________。
⑶B与D反应生成F的化学方程式为__________________________________。
⑷该晶体水合物的化学式为_________________________________。
(5)在空气中灼烧X·6H2O晶体能否得到X无水盐?????(填:能或否),理由是????????????。
参考答案:
⑴化合⑵2H++2e-=H2↑?⑶4NH3+5O2<
本题解析:
根据框图和题干信息,A溶液中含有SO42-,G为氢氧化铁,逆推C为氢氧化亚铁;B、D、E、F均为无色气体,说明它们可能是中学化学中O2,H2,NO,NH3,CO,CO2,SO2等。由A和C成分逆推X可能含有FeSO4;
由“X·6H2O与氢氧化钠溶液,加热”生成无色气体B,中学只有铵盐与碱反应生成无色气体氨气,所以,X中含有NH4+,B为NH3,氨与氧气发生催化氧化,D为氧气;X与氢氧化钠反应,A为硫酸钠,电解硫酸钠水溶液,实质是电解水,产物是氢气(E)和氧气(D)。综合分析知,X为FeSO
本题难度:一般