微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (5分)实验室用8.7g的MnO2与足量的浓盐酸制取氯气:求生成氯气的体积(标准状况)和被氧化的HCl的物质的量。
参考答案:(5分)
MnO2+4HCl=Mn Cl2+Cl2↑+
本题解析:略
本题难度:一般
2、实验题 某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
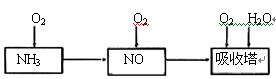

(1)工业上用氨气制取NO的化学方程式是???????????。
(2)连接好装置后,首先进行的操作是?????????????。
(3)通入a气体的目的是?????????????????????.
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是
2NO2+Na2CO3=====NaNO2+?????????+?????????
(5)已知:温度低于21.15°C时,NO2几乎全部转变为N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是?????????。
 ??(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g)????? N2O4(g)的平衡常数K=?????。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为???????????。
??(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g)????? N2O4(g)的平衡常数K=?????。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为???????????。
参考答案:
(1) 本题解析:略
本题解析:略
本题难度:一般
3、实验题 (13分)(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)
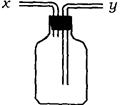
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,

填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
参考答案:(1)??? A B E??? (2) C+2H2SO4
本题解析:(1)由图可以看出y导管插入到试剂瓶的底部,因此可用来干燥某些气体,也可用来除去气体中的某些杂质,或者用来收集密度大于空气的某些气体。若瓶内盛水,用以测量某难溶于水的气体的体积,则进气口应是x导管。同样瓶内贮存难溶于水的气体,加水时气体可被排出,进气口同样应是x导管。收集密度比空气小的气体,进气口应是x导管。故正确的答案是A B E。
(2)浓硫酸具有强氧化性,在加热的条件下可氧化单质碳,方程式为C+2H2SO4 CO2↑+2SO2↑+2H2O。产物有三种水蒸气、CO2和SO2,验证水蒸气用无水硫酸铜,CO2用饱和石灰水,SO2用品红溶液。由于后两者都需要通过溶液,因此首先验证水蒸气。因为SO2也可以使石灰水变混浊,因此在检验CO2之前,需要先检验SO2,并且还要完全除去SO2,以避免干扰CO2的检验。
CO2↑+2SO2↑+2H2O。产物有三种水蒸气、CO2和SO2,验证水蒸气用无水硫酸铜,CO2用饱和石灰水,SO2用品红溶液。由于后两者都需要通过溶液,因此首先验证水蒸气。因为SO2也可以使石灰水变混浊,因此在检验CO2之前,需要先检验SO2,并且还要完全除去SO2,以避免干扰CO2的检验。
本题难度:一般
4、实验题 (15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知: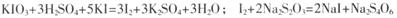
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数="______" ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
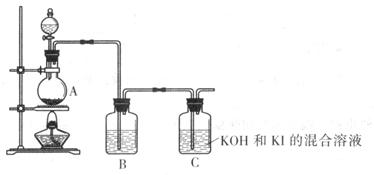
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
参考答案:(1)250mL容量瓶、胶头滴管(2分,各1分,不写250m
本题解析:(1)考查一定物质的量浓度溶液的配制,根据实验原理和已知的仪器可知,还缺少的是250mL容量瓶、胶头滴管。
(2)由于淀粉和碘反应显蓝色,所以终点时的实验现象是溶液蓝色褪色,半分钟内不恢复蓝色。
(3)利用关系式进行计算。根据方程式可知KIO3~3I2~6Na2S2O3,所以25ml溶液中碘酸钾的物质的量是0.012cmol÷6=0.002cmol,所以此加碘盐中KIO3的质量分数=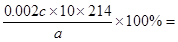
(4.28c)/a×100%。
(4)装置A是制取氯气的发生装置,方程式为MnO2+4H++2Cl-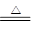 Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(5)由于盐酸易挥发,所以制取的氯气中含有氯化氢,而氯化氢能和氢氧化钠反应,导致实验失败,所以再通入装置C之前,需要除去氯化氢,可利用饱和食盐水除去氯化氢。
(6)氯气的还原产物是氯离子,所以根据反应物和生成物可知,方程式为I-+3Cl2+6OH-=IO3-+6 Cl-+3H2O。
(7)由于氯气有毒,所以必需有尾气处理装置,否则易造成环境污染。
本题难度:一般
5、填空题 (12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产

根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为??????????????。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替??????????
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是??????。
A.适当加热???? B.加压?????????????????? C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是?????????????????。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是?????????。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为???????? ?。
参考答案:每空均2分
(1)100%
(2)否,因为乙醇与
本题解析:略
本题难度:简单