微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知0.4 mol液态肼(N2H4)与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量,该反应的热化学方程式为 。
又已知:H2O(l)=H2O(g) ΔH =+44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 。
参考答案:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)
本题解析:考查热化学方程式的书写。1mol液态肼放出的热量是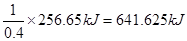 ,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.625 kJ/mol;16g液态肼是0.5mol,生成气态水时放出的热量是0.5mol×641.625 kJ/mol=320.8125kJ,生成的2mol水变成液态又放出88kJ热量,所以最终放出的热量是320.8125kJ+88kJ=408.813 kJ.
本题难度:一般
2、简答题 按要求书写热化学方程式(是离子反应的也可用离子方程式表示).
(1)表示强酸和强碱中和热的热化学方程式:______.
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:______.
(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式:______.若1g水蒸气转化成液态水放热2.5kJ,则反应H2(g)+
1
2
O2(g)=H2O(l)的△H=______kJ?mol-1,H2的燃烧热为______kJ?mol-1
(4)已知A、B两种气体在一定条件下可发生反应:2A+B═C+3D+4E.现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成.在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×106Pa,又测得反应共放出QkJ热量.试根据上述实验数据写出该反应的热化学方程式______.
参考答案:(1)强酸和强碱中和热的热化学方程式为:H+(aq)+OH-
本题解析:
本题难度:一般
3、填空题 (14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJ?moL-1
H2O(g)=H2O(l) △H=—44.0kJ?moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol 2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。
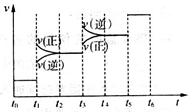
①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。
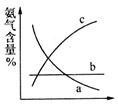
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
参考答案:(每空2分,共14分)(1)CO(g)+H2O(g)=CO2
本题解析:
试题分析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1,②2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ?moL-1,则根据盖斯定律可知(①—②)÷2即可得到CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol 2NH3(g) △H=—92.4kJ/mol
①t3时正逆反应速率均增大,其中逆反应速率大于正反应速率,平衡向逆反应方向进行。由于正方应是体积减小的放热的可逆反应,则引起平衡移动的条件是升高温度。平衡向正反应方向进行,氨气的含量高,因此根据图像可知表示平衡混合物中NH3的含量最高的一段时间是t2-t3。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则根据方程式可知生成氨气是0.5mol×2=1.0mol,剩余氨气0.5mol,氢气2mol—1.5mol=0.5mol,则反应在T℃时的平衡常数为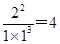 mol-2·L2。 mol-2·L2。
③目前工业合成氨的原理是: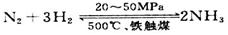
图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,增大压强平衡向正反应方向进行,氨气的含量升高,所以变化趋势正确的是c;当横坐标为温度时,升高温度平衡向逆反应方向进行,氨气的含量降低,则变化趋势正确的是a。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,二者恰好反应生成氯化铵,铵根水解溶液显酸性,则所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-) 。
考点:考查盖斯定律、外界条件对平衡状态的影响、平衡常数计算以及浓度大小比较
本题难度:困难
4、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+ 1
2
O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
根据上述反应,下列说法正确的是( )
A.反应①中的能量变化如图所示

B.CH3OH转变成H2的过程一定要吸收能量
C.1?mol?CH3OH充分燃烧放出的热量为192.9?kJ
D.可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8?kJ/mol
参考答案:D
本题解析:
本题难度:简单
5、选择题 已知热化学方程式:2H2(g)+O2(g)═2H2O(g);△H1=-483.6kJ?mol-1.
则对于热化学方程式:2H2O(g)═2H2(g)+O2(g);△H2=bkJ?mol-1的说法正确的是( ? ) A.热化学方程式中H2O前面的“2”表示“每2个液态水分子分解,就有bkJ?mol-1的热量变化”
B.b=+483.6
C.|△H2|>|△H1|
D.|△H2|<|△H1|
参考答案:B
本题解析:
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772