微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是(?????? )
参考答案:B
本题解析:略
本题难度:简单
2、实验题 (16分)某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
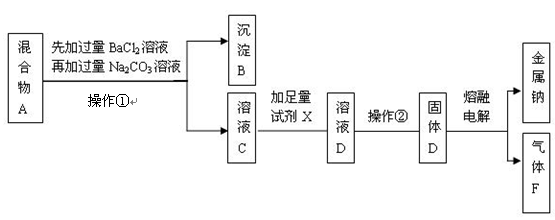
(1)在混合物A中先加过量的BaCl2溶液除去的离子是???????????????;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是??????????????????????。
(2)在溶液C中加入的足量试剂X是 ????????????????。
(3)操作②的分离方法分别是?????????。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为??????????????????????????????。
参考答案:(1)SO42-;Ba2+,Ca2+(2)HCl溶液(3)蒸
本题解析:
试题分析:(1)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,因此加入氯化钡溶液是除去硫酸钠的;碳酸钠能与氯化钙反应产生碳酸钙沉淀,能与氯化钡反应产生碳酸钡沉淀,因此加入碳酸钠溶液的目的是除去原混合物中的氯化钙以及过量的氯化钡;
(2)溶液C中含有过量的碳酸钠和氯化钠,加入试剂x将碳酸钠转化成氯化钠,因此加入的x是盐酸,反应的化学方程式为2HCl+Na2CO2=2NaCl+CO2↑+H2O;
(3)操作①是将固体与液体分离,用过滤法,操作②是将氯化钠溶液中氯化钠结晶析出,应用蒸发溶剂的方法.
(4)Cl2与NaOH溶液反应方程式为:Cl2+ 2NaOH="=NaCl" +NaClO +H2O。
点评:本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质。
本题难度:一般
3、选择题 制备卤素磷酸钙荧光粉所用的高纯氯化钙中混有镁离子,除去的方法是把氯化钙水溶液加热到90℃-95℃,在不断搅拌下加入适当的沉淀剂,使镁离子生成沉淀过滤除去。此沉淀剂最好选用……(???)
A.氢氧化钙乳浆
B.碳酸钠溶液
C.碳酸氢钠溶液
D.氢氧化钠溶液
参考答案:A
本题解析:其余都会引入新的杂质钠离子Na+.
本题难度:一般
4、填空题 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题:
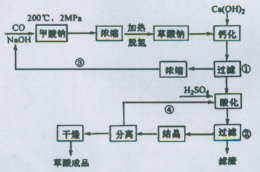
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____???????。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是????????,滤渣是____?????;过滤操作②的滤液是????????和???????,滤渣是____???????????。
(3)工艺过程中③和④的目的是____????????????????????。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___???????????????。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____??????????;
列式计算该成品的纯度?????????????????????。
参考答案:
 本题解析:
本题解析:
试题分析:⑴CO和NaOH在一定条件下合成甲酸钠的反应可用观察法将其配平;甲酸钠加热脱氢(产生H2),通过观察法并结合原子守恒得另一生成物为Na2C2O4。
⑵根据“钙化”反应:Na2C2O4+Ca(OH)2=CaC2O4↓+2NaOH,由此可确定过滤操作①的滤液是NaOH,滤渣是CaC2O4;根据“酸化”反应:CaC2O4+H2SO4=CaSO4+ H2C2O4,由此可确定过滤操作②的滤液是H2C2O4,滤渣是CaSO4;
⑶该工艺过程中③和④(“回头”)分别循环利用氢氧化钠和硫酸,减小污染,也可降低成本。
⑷若在甲酸钠脱氢后生成的Na2C2O4中直接用硫酸酸化制备草酸,会产生Na2SO4杂质。
⑸根据得失电子守恒有5C2O42-+2MnO4-――2Mn2++10CO2↑,再根据电荷守恒有5C2O42-+2MnO4-+16H+――2Mn2++10CO2↑,最后根据原子守恒得5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;最后根据该反应方程式建立关系式“5(H2C2O4·2H2O)~2KMnO4”,得该成品的纯度为:
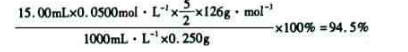 。
。
本题难度:一般
5、选择题 对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
?
| 操作
| 现象
| 结论
|
A.
| 滴加氯水和CCl4,振荡、静置
| 下层溶液显紫色
| 原溶液中有I-
|
B.
| 滴加BaCl2溶液
| 生成白色沉淀
| 原溶液中一定有SO42-
|
C.
| 用洁净铂丝蘸取溶液进行焰色反应
| 火焰呈黄色
| 原溶液中有Na+、无K+
|
D.
| 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
| 试纸不变蓝
| 原溶液中一定无NH4+
?
参考答案:A
本题解析:
试题分析:A、氯水氧化碘离子生成碘单质,加四氯化碳萃取后在下层,则下层溶液显紫色,故A正确;B、检验溶液中有SO42-,应先加入盐酸,如无现象,再加入氯化钡,如生成沉淀,说明含有SO42-,以排除Cl-的干扰,故B错误;C、黄色火焰可以覆盖K+的浅紫色火焰,故检验K+需通过蓝色钴玻璃观察火焰,正确操作为:用洁净铂丝蘸取溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈黄色,原溶液中有钠离子、无钾离子,故C错误;D、氨气极易溶于水,若溶液中含有少量的NH4+时,滴加稀NaOH溶液不会放出NH3,故D错误。
本题难度:一般
|