微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作正确的是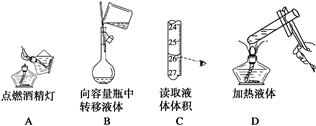
参考答案:B
本题解析:
试题分析:不能用燃着的酒精灯引燃另一只酒精灯,防止失火,A错误;向容量瓶中转移液体用玻璃棒引流,玻璃棒末端位于容量瓶刻度线以下,B正确;读取滴定管中液体体积要平视,C错误;加热试管中液体时,试管中液体不能超过试管容积的1/3,D错误。
点评:量筒无“0”刻度,刻度由下向上增大;滴定管“0”刻度在上方,从上向下刻度增大。
本题难度:简单
2、选择题 化学是以实验为基础自然科学,化学实验操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法正确的是
A.做氢气还原氧化铜的实验时先加热再通氢气
B.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
C.浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤
D.实验室加热制取且排水法收集氧气时先撤导管再撤酒精灯
参考答案:D
本题解析:A项做氢气还原氧化铜的实验时先通氢气以排净装置中的空气再加热;B项中实验结束后将所有的废液倒入废液缸,不能到入下水道,应废液中可能有酸液将腐蚀管道;C项先用抹布擦试,后用水冲洗,再用NaHCO3稀溶液冲洗;D项中是为防止倒吸现象
本题难度:简单
3、选择题 实验室制备下列气体的反应原理,从化学反应的分类角度来考虑,不属于同类的是(???)
A.实验室制氯气
B.酸碱中和滴定
C.实验室制氢气
D.实验室制一氧化氮
参考答案:B
本题解析:略
本题难度:一般
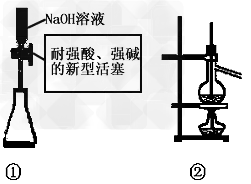
4、选择题 以下实验原理或操作中,正确的是
 [???? ]
[???? ]
A.装置①量取15.00?mLNaOH溶液
B.装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物
C.室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色
D.纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮
参考答案:A
本题解析:
本题难度:一般
5、实验题 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
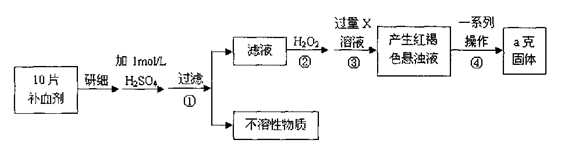 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加????????????,该过程的现象为:?????????????????。
(2)步骤②加入过量H2O2的目的:???????????????????。
(3)步骤③中反应的离子方程式:????????????????????????????。
(4)步骤④中一系列处理的操作步骤:过滤、?????????、灼烧、?????????、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量?????????g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需???????????????。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是?????????。
a.稀硝酸?? b.稀硫酸??? c.稀盐酸??? d.浓硝酸
③滴定到终点时的颜色为?????????色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H?2?O的片剂。来补充铁,则正常人每天服需用含???????????mgFeSO4·7H2O为片剂。
参考答案:(1)氯水(或双氧水、稀硝酸等合理氧化剂)(1分)现象:或溶
本题解析:
试题分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+。检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液由浅绿色变为血红色,说明含有Fe2+。
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+。
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量。
(5)ag固体是氧化铁,则根据铁原子守恒可知,每片补血剂含铁元素的质量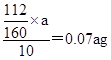 。
。
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需要250mL容量瓶。
②硝酸是氧化性酸,能和亚铁离子反应,生成铁离子,不能用硝酸酸化。高锰酸钾溶液能氧化盐酸生成氯气,不能用盐酸酸化,实验应该用稀硫酸酸化,答案选b。
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色。
(7)14mg铁即为FeSO4?7H2O片剂中铁的质量,所以需要FeSO4?7H2O片剂质量为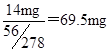
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,贴近高考,有利于激发学生的学习兴趣和学习积极性。清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力。
本题难度:一般