0
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
② 该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
参考答案:(1) CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微
本题解析:
试题分析:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率,因此能起到相似作用的应该是含有铜离子的,所以为氯化铜。影响化学反应速率的因素有,温度,催化剂,浓度,压强,反应物的接触面积。AB应比较的是硫酸铜溶液对该反应的影响。因此硫酸的量应与A的相同,所以V1=30 据表格可知,CDEF应该是呈两倍的关系递增,所以V6="10" 。从图表可知饱和硫酸铜的体积与水的体积之和应为20毫升。所以V9应为20减去2.5等于17.5. :当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降主要是由于当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
考点:考查影响化学反应速率因素的相关知识。
本题难度:一般
2、选择题 Li-A1/FeS电池是一种正在开发的车载电池,该电池中正极电极反应式为:2Li++FeS+2e- =Li2S+Fe。有关该电池的叙述正确的是(????)
A.该电池的总反应式为:2Li+FeS=Li2S+Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极的电极反应式为:Li2S+Fe-2e- = 2Li++FeS
参考答案:A
本题解析:
试题分析:该电池的负极材料为Li,电极反应为2Li-2e-+S2-=Li2S。正极材料为FeS。正极反应为2Li++FeS+2e- =Li2S+Fe。总反应式为2Li+FeS=Li2S+Fe。在充电时,阴极发生还原反应。电极式为的电极反应式为:Li2S+ 2e- = 2Li+S2-。因此正确选项为A.
本题难度:一般
3、选择题 将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性减小
D.甲、乙溶液均变蓝
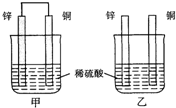
参考答案:A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜
本题解析:
本题难度:一般
4、选择题 将AsO +2I—+2H+ +2I—+2H+  AsO AsO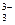 +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作(盐桥能能让离子通过): +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作(盐桥能能让离子通过):

甲组:向B烧杯中逐滴浓盐酸;
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是?? (??? )
A.甲组操作过程中,C2做负极
B.乙组操作过程中,C1上发生的电极反应为:
2I—-2e—=I2
C.两次操作过程中,微安表(G)指针的偏转方向相反
D.甲组操作时该装置为原电池,乙组操作时该装置为电解池
参考答案:C
本题解析:甲组滴加盐酸时,总反应向右移动,此时I—为还原剂在C1上失去电子,C1是负极;乙组加NaOH,总反应向左进行,AsO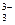 是还原剂在C2上失去电子,此时C1上是I2得电子;甲、乙的操作中装置均为原电池 是还原剂在C2上失去电子,此时C1上是I2得电子;甲、乙的操作中装置均为原电池
本题难度:简单
5、选择题 A、B、C三种金属片,把A、B?用导线连接后同时浸入稀硫酸溶液中,A是负极;把B、C?用导线连接后同时浸入稀硫酸溶液中,C发生还原反应.三种金属的活动性顺序是( )
A.A>B>C
B.C>B>A
C.A>C>B
D.B>A>C
参考答案:原电池中较活泼金属作负极,较不活泼金属作正极;负极上失电子发
本题解析:
本题难度:简单
|