微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (9分)将铜片、锌片和250mL稀硫酸组成原电池,当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全。
(1)该原电池的负极反应式为??????????????????????????
(2)原稀硫 酸的物质的量浓度是?????????mol·L-1
酸的物质的量浓度是?????????mol·L-1
(3)列式计算锌片减少 的质量。
的质量。
参考答案:(1) 本题解析:略
本题解析:略
本题难度:简单
2、选择题 某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池。下列说法正确的是(??? ):①正极上O2得到电子,发生还原反应②每消耗1molCH3OH可以向外电路提供6mole-③该电池的总反应为:2CH3OH+3O2=2CO2+4H2O④电池放电后,溶液的pH不断升高
A.①②
B.①③
C.②③
D.③④
参考答案:A
本题解析:
试题分析:利用CH3OH和O2的反应制成燃料电池,在电池反应中O2 作氧化剂,得电子发生还原反应,应该做电池正极,所以①正确;在反应中每消耗1molCH3OH反应1.5mol的O2 ,所以转移电子6mol,②正确;CH3OH和O2 反应是在碱性介质中进行的,所以生成的CO2 会与碱反应,反应式应该为2CH3OH+3O2 +4KOH=2K2CO3+6H2O,所以③错误;随着反应的进行,KOH逐渐被消耗,所以溶液的pH值不断下降,④错误;只有①②正确,故选A。
本题难度:一般
3、选择题 如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
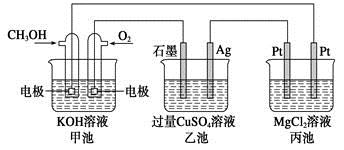
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
参考答案:D
本题解析:甲池为原电池,作为电源,电解乙池、丙池两个电解池。根据原电池的形成条件,通入CH3OH的一极为负极,通入O2的一极为正极,所以石墨、Pt(左)作阳极,Ag、Pt(右)作阴极;B项,负极反应:CH3OH-6e-+8OH-=CO32-+6H2O;C项,应加入CuO;D项,丙池中:MgCl2+2H2OMg(OH)2↓+Cl2↑+H2↑,消耗0.0125 mol O2,转移0.05 mol电子,生成0.025 mol Mg(OH)2,其质量为1.45 g。答案选D。
本题难度:一般
4、填空题 如图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答:
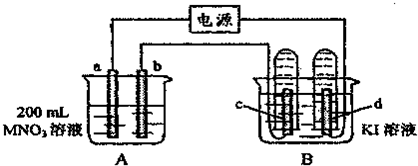
(1)a为______极,c极的电极反应式为______.
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:______,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为______.
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了______moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为______g/mol.
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到25.0mL?0.100mol?L-1HCl溶液中,当加入31.25mL溶液时刚好沉淀完全.试计算:电解前A烧杯中MNO3溶液的物质的量浓度.______mol?L-1.
参考答案:由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,
本题解析:
本题难度:简单
5、选择题 图中,两电极上发生的电极反应分别为:a极:2Ag++2e-=2Ag??b极:Fe-2e-=Fe2+下列说法不正确的是( )
A.该装置一定是电解池
B.a、b可能是同种电极材料
C.装置中电解质溶液不一定含有Ag+
D.装置中发生的反应方程式一定是Fe+2Ag+=Fe2++2Ag

参考答案:A.该装置可为电解池,a为阴极,b为阳极,也可为原电池,a为
本题解析:
本题难度:一般