微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某二元酸(化学式H2A)在水中的电离方程式是:H2A = H+ + HA-,HA- ?H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
?H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
A.因为A2-+H2O  ?HA-+OH-,所以Na2A溶液显碱性
?HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH-)
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
参考答案:B
本题解析:略
本题难度:简单
2、选择题 常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH > 7,且c(OH-) > c(Na+) >c(H+) >c(CH3COO-)
B.pH > 7,且c(Na+) + c(H+) = c(OH-) + c(CH3COO-)
C.pH < 7,且c(CH3COO-) >c(H+) > c(Na+) > c(OH-)
D.pH = 7,且c(CH3COO-) = c(Na+) > c(H+) = c(OH-)
参考答案:A
本题解析:正确答案:A
A、违背电荷守恒规律;B、电荷守恒; C、正确;D、由电荷守恒c(Na+) + c(H+) = c(OH-) + c(CH3COO-),可知,中性时,c(CH3COO-) = c(Na+) > c(H+) = c(OH-)
本题难度:困难
3、选择题 下列溶液中的各组离子能大量共存的是
A.pH=2的溶液中:Ca2+、ClO-、Na+、SO32-
B.c(H+)=1.0×10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-
C.由水电离产生的c(H+)=10-13mol/L的溶液中:Fe2+、NH4+、NO3-、Cl-
D.无色透明的溶液中:Cu2+、Na+、SO42-、HCO3-
参考答案:B
本题解析:分析:A.pH=2的溶液中有大量的H+;
B.c(H+)=1.0×10-12mol/L的溶液,c(OH-)=1.0×10-2mol/L,溶液为碱性;
C.由水电离产生的c(H+)=10-13mol/L的溶液中,水的电离受到抑制,溶液为酸或碱溶液;
D.Cu2+为蓝色,且Cu2+、HCO3-相互促进水解.
解答:A.pH=2的溶液中有大量的H+,ClO-、SO32-都与H+反应,则不能共存,故A错误;
B.c(H+)=1.0×10-12mol/L的溶液,c(OH-)=1.0×10-2mol/L,溶液为碱性,该组离子之间不反应,故B正确;
C.由水电离产生的c(H+)=10-13mol/L的溶液中,水的电离受到抑制,溶液为酸或碱溶液,酸溶液中Fe2+、NO3-发生氧化还原反应,碱溶液中Fe2+、NH4+都与OH-反应,故C错误;
D.Cu2+为蓝色,且Cu2+、HCO3-相互促进水解,则不能共存,且与无色溶液不符,故D错误;
故选B.
点评:本题考查离子的共存问题,明确习题中信息及信息的应用,熟悉离子之间的反应即可解答,题目难度不大.
本题难度:困难
4、选择题 下列离子方程式中,只能表示一个化学反应的是? [???? ]
①Ag++Cl-?=AgCl↓②Ba2++2OH-+2H++SO42- =?BaSO4↓+2H2O
③CO32-+2H+ =CO2↑+H2O???④Fe+Cu2+ =Fe2++Cu ⑤Cl2+H2O=H++Cl-+HClO
A.①③
B.②④
C.②⑤
D.只有⑤
参考答案:D
本题解析:
本题难度:一般
5、填空题 现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
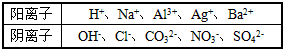
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C 溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀。
请回答下列问题:
(1)A、B、C、D、E的化学式分别为__________、__________、_________、__________、___________
(2)常温下,浓度均为0.1mol/L的A、B溶液中H2O的电离程度的关系是A____(填“<”“>”或“=”)B。
(3)在100 mL 0.1 mol/L E溶液中,逐滴加A 35 mL 2 mol/LNaOH溶液,最终得到沉淀的物质的量为_______
mol。
参考答案:(1)Na2CO3;Ba(OH)2;HCl;AgNO3;Al
本题解析:
本题难度:一般