微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是
A.未冷却即转移、定容
B.未洗烧杯及玻璃棒
C.定容时俯视刻度线观察液面
D.容量瓶中原有少量蒸馏水
参考答案:B
本题解析:
试题分析:根据cB=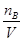 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V
引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓
本题难度:一般
2、选择题 下列操作不正确的是
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.制氧气时,用排水法收集氧气出现倒吸现象,立即松开试管上的橡皮塞
C.用蒸馏水润湿了的pH试纸,测得某盐酸溶液的pH为2
D.过滤时用玻璃棒搅拌以加快过滤速度
参考答案:CD
本题解析:用pH试纸测量溶液的pH值,试纸不能事先润湿,选项C不正确;过滤时玻璃棒的作用时引流,而不能搅拌,选项D不正确,所以正确的答案选CD。
本题难度:一般
3、选择题 用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3mol/LNaCl溶液和现300mL0.15mol/L的AgNO3溶液,当甲中产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液在室温下的pH为(设混合后总体积为500mL,且所产生的Cl2全部逸出)??????????????????????????????????????????????
A.2
B.7
C.11.7
D.12
参考答案:D
本题解析:考点:电解原理;pH的简单计算.
分析:两个电解池串联,分别发生的反应为:2NaCl+2H2O  2NaOH+H2↑+Cl2↑;AgNO3+2H2O
2NaOH+H2↑+Cl2↑;AgNO3+2H2O  4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.
4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.
解:两个烧杯中发生的反应分别为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
4AgNO3+2H2O 4Ag+4HNO3+O2↑,
4Ag+4HNO3+O2↑,
生成氯气的物质的量为:
n(Cl2)=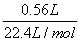 =0.025mol,
=0.025mol,
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2 1
n(NaOH) 0.025mol
n(NaOH)=0.05mol
两烧杯中含有的n(NaCl)=0.06mol,n(AgNO3)=0.045mol,
以当甲中产生0.56L(标准状况)Cl2时停止电解时,硝酸银完全电解,并进一步电解水,
4AgNO3+2H2O 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
4 4
0.045mol n(HNO3)
n(HNO3)=0.045mol
将两个烧杯混合,碱过量,溶液中过量的OH-离子的物质的量为n(OH-)=0.05mol-0.045mol=0.005mol,
混合后溶液的c(OH-)=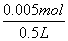 =0.01mol/L,
=0.01mol/L,
c(H+)=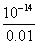 =10-12mol/L,所以PH=12.
=10-12mol/L,所以PH=12.
故选D.
本题难度:一般
4、实验题 化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
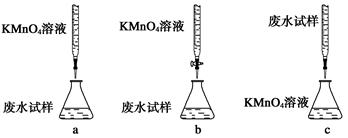
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加??? 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。
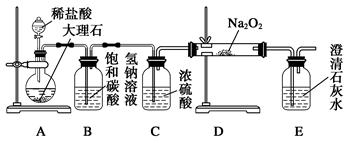
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________??????????????????????????????????????__________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________?????????????????????????????????????___________。
参考答案:(1)c(2)①b ②2MnO 本题解析:
本题解析:
试题分析:(1)a.高温下铁能和水蒸气反应,实验不能用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数,a不正确;
b.浓硫酸具有脱水性,不能用干燥的pH试纸测定浓硫酸的pH,b不正确;
c.量筒可以读数到0.1ml,所以用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液,c正确,答案选c。
(2)①酸性高锰酸钾溶液应该放在酸式滴定管中,a中酸性高锰酸钾溶液放在碱式滴定管中,因此a不正确,b正确;应该用高锰酸钾溶液滴定废水,选项c不正确,答案选b。
②高锰酸钾具有强氧化性,能把SO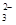 氧化,所以滴定过程中,有关反应的离子方程式是2MnO
氧化,所以滴定过程中,有关反应的离子方程式是2MnO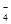 +5SO
+5SO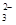 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO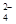 +3H2O。
+3H2O。
(3)将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体,加热直到液体变为透明的红褐色停止加热,无需玻璃棒搅拌。所以该实验失败的原因是搅拌导致胶体聚沉。
(4)①盐酸易挥发,生成的CO2中含有氯化氢气体,所以饱和碳酸氢钠溶液的作用是除去HCl杂质气体。
②碳酸钙是难溶性物质,存在溶解平衡,方程式是CaCO3(s)  ?Ca2+(aq)+CO
?Ca2+(aq)+CO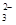 ?(aq)。
?(aq)。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容在高考命题中一方面是单独命题,另一方面是出现在综合实验试题中,就前者来说,今后仍然是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:困难
5、填空题 (3分).选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是____________.
参考答案:不溶于水,且比水更容易使碘溶解
本题解析:略
本题难度:简单