微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把 L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用 mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗 molBaCl2,则原溶液中
molBaCl2,则原溶液中 (NO
(NO )为( )
)为( )
A. mol·L-1
mol·L-1
B. mol·1-1
mol·1-1
C. mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:B
本题解析:一份用 mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,说明每份溶液中含有的NH4+是bmol。另一份与氯化钡溶液完全反应消耗 mol
mol
本题难度:简单
2、选择题 下列方程式不能用Ba2++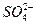 ====BaSO4↓来表示的是(???)
====BaSO4↓来表示的是(???)
A.Ba(NO3)2+H2SO4====BaSO4↓+2HNO3
B.BaCO3+H2SO4====BaSO4↓+CO2↑+H2O
C.Na2SO4+BaCl2====BaSO4↓+2NaCl
D.BaCl2+H2SO4====BaSO4+2HCl
参考答案:B
本题解析:题干中的离子方程式是可溶性钡盐与硫酸或可溶性硫酸盐反应的一类化学反应的离子方程式,符合它的选项有A、C、D三项,B项中的离子方程式写出来即是:Ba2++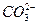 +2H++
+2H++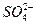 本题难度:简单
本题难度:简单
3、实验题 (8分)某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为:
①??????????????????????????????????;②Al2O3+Na2CO3 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(提示:NaAlO2易溶于水并转化为Na[Al (OH)4])
(2)最后得到的沉淀物是????????,生成沉淀的离子方程式为????????????????????。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用??????坩埚。
参考答案:(1)SiO2+Na2CO3 本题解析:这是一道信息给予题,根据题示情境分析:(1)高岭土熔化时,其成分中的SiO2和Al2O3与Na2CO3反应生成Na2SiO3和NaAlO2。(2)熔块加水使Na2SiO3和NaAlO2溶解与其他杂质分离,在过滤后的滤液中加入盐酸则使Na2SiO3、Na[Al (OH)4]分别与过量的盐酸反应,生成H4SiO4沉淀和AlCl3溶液,过滤得滤液即为净水剂。(3)因为瓷坩埚中含有SiO2,氧化铝坩埚主要成分是Al2O3,它们都能与Na2CO3在高温下发生反应,故熔融样品时只能用铁坩埚。
本题解析:这是一道信息给予题,根据题示情境分析:(1)高岭土熔化时,其成分中的SiO2和Al2O3与Na2CO3反应生成Na2SiO3和NaAlO2。(2)熔块加水使Na2SiO3和NaAlO2溶解与其他杂质分离,在过滤后的滤液中加入盐酸则使Na2SiO3、Na[Al (OH)4]分别与过量的盐酸反应,生成H4SiO4沉淀和AlCl3溶液,过滤得滤液即为净水剂。(3)因为瓷坩埚中含有SiO2,氧化铝坩埚主要成分是Al2O3,它们都能与Na2CO3在高温下发生反应,故熔融样品时只能用铁坩埚。
本题难度:简单
4、选择题 工业废气的氮氧化合物是造成大气污染的主要来源之一,为保护环境,工业上常通入氨与之发生反应,NOX + NH3 →N2 + H2O 转化为无毒的N2,现有NO2、NO的混合气体3L,可用同温同压下3.5L NH3恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为(??)
A.3:1
B.2:1
C.1:1
D.1:4
参考答案:(A)
本题解析:设NO2的体积为x,NO的体积为y,则有:x + y = 3;
得失电子数相等得:4x+2y=3.5×3
解得x =" 2.25L????" y = 0.75L
本题难度:简单
5、选择题 某金属首饰可能含有铜或银,欲检验其是否用纯金制成,可把样品浸入某溶液一段时间后,取出洗净、干燥后称量,根据质量是否变化即可判断。可以选用的溶液是
A.稀硫酸
B.盐酸溶液
C.稀硝酸
D.氢氧化钠溶液
参考答案:C
本题解析:稀硫酸、盐酸溶液、氢氧化钠溶液都不与铜、银反应。
本题难度:简单