微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某元素氢化物的化学式为RH3,在R的最高价氧化物中氧的质量分数为56.3%,则R的相对原子质量为________,R元素在周期表中的位置为________周期________族。
参考答案:31?? 3??ⅤA
本题解析:根据RH3得R的最高正价为+5,则最高价氧化物的化学式为R2O5,根据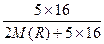 ×100%=56.3%,求出M(R)=31,所以为磷元素,位于3周期VA族。
×100%=56.3%,求出M(R)=31,所以为磷元素,位于3周期VA族。
本题难度:简单
2、选择题 在100mL混合溶液中,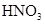 和
和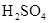 物质的量浓度分别为
物质的量浓度分别为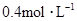 和
和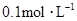 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中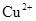 物质的量浓度(
物质的量浓度(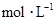 )为( )
)为( )
A.0.15
B.0.225
C.0.35
D.0.45
参考答案:B
本题解析:由于在酸性条件下,NO3-仍然具有氧化性,所以应该用离子方程式进行过量判断,即

 本题难度:一般
本题难度:一般
3、选择题 在标准状况下,将O2与NO按3∶4的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,(假设烧瓶内溶液不向外扩散)最后烧瓶内溶液的物质的量浓度为(???)
A.0.045 mol·L-1
B.0.036 mol·L-1
C.0.026 mol·L-1
D.0.030 mol·L-1
参考答案:C
本题解析:4NO+3O2+2H2O====4HNO3,假设烧瓶的体积为7 mol×22.4 L·mol-1,最后烧瓶被充满,生成4 mol硝酸,硝酸溶液的物质的量浓度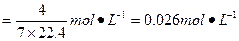 。
。
本题难度:简单
4、计算题 向盛有400 mL某浓度稀HNO3的大烧杯中加入W g铁粉(还原产物以NO计),充分反应后,铁粉质量减少16.8 g,再往烧杯中加入V mL 4.0? mol·L-1的稀H2SO4,充分反应后,铁粉质量又减少8.4 g,此时铁粉仍有剩余。求:
(1)稀HNO3的物质的量浓度。
(2)V的值。
(3)要使反应中有H2生成,W的取值范围__________。
参考答案:(1)2.0? mol-1·L-1(2)50 mL
(
本题解析:(1)
3Fe??? +???? 8HNO3====3Fe(NO3)2+2NO↑+4H2O
3??????????? 8
 ?n1
?n1
n1(HNO3)="0.8" mol
c(HNO3)= 本题难度:简单
本题难度:简单
5、实验题 某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
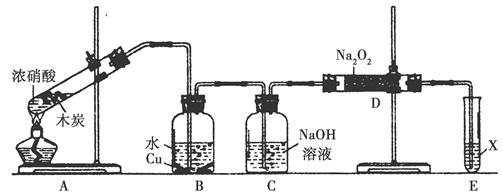
(1)组装好仪器后,必须进行的一项操作是_________________。
(2)装置A的试管中发生反应的化学方程式是_______________。
(3)推测B中可以观察到的主要现象是________;C装置的作用是________。
(4)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是________;可以通过适当改进,不产生Y物质,请你提出改进方法:______________________。
(5)已知:亚硝酸是弱酸,不稳定,室温下存在反应3HNO2=HNO3+2NO↑+H2O;在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
①写出检验D中产物是亚硝酸钠的方法:_________________;
②E装置中试剂X可以是________。
A.稀硫酸
B.酸性高锰酸钾溶液
C.稀硝酸
D.水
参考答案:(1)检查装置的气密性
(2)C+4HNO3(浓) <
本题解析:(3)根据装置图可知,A中产生的NO2在B中与水反应生成HNO3和NO,其中HNO3与铜反应,故铜片溶解,溶液变蓝,产生气泡;由于A中还产生了CO2,故在通入D之前应先用氢氧化钠溶液将其除去。(4)由于NO通过氢氧化钠溶液进入D装置时会带入水蒸气,根据原子守恒可知,生成的固体物质应该还有NaOH;若要避免生成NaOH,应该除去水蒸气。(5)根据所给信息可知,若检验亚硝酸钠,可以将其在酸性溶液中分解;也可以将其与酸性高锰酸钾溶液反应。
点拨:本题考查NO及其他含氮化合物的性质,考查考生灵活解决问题的能
本题难度:一般