微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将一定量的氯气通入250 mL溴化钾溶液中,然后将所得的溶液蒸干,并将残渣灼烧,得到干燥的残渣40 g,分析残渣,其中含25%的化合态的溴,试计算:
(1)通入的一定量的氯气是多少克?(氯气无剩余)
(2)原溴化钾溶液含KBr多少克?
参考答案:(1)11.97 g? (2)55.01 g
本题解析:溴化钾溶液中通入氯气,必然会产生氯化钾和溴,由已知25%的化合态的溴可设法求出溴化钾的质量,从而求出40 g残渣中氯化钾的质量,再根据化学反应方程式将氯化钾当成已知量以求算通入的氯气是多少克,并求原溶液中的溴化钾为多少克。搞清残渣成分和正确换算是关键。
40 g残渣中所含Br-的质量为:40 g×25%="10" g。求KBr的质量:由Br—KBr的质量比:80∶119得KBr的质量=10×119÷80="14.87" g。设x g Cl2与y g KBr反应生成了25.13 g KCl,则
本题难度:简单
2、选择题 下列有关Cl、N、S等非金属元素化合物的说法正确的是:(?????)
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥HI气体
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Cl2与SO2以等物质的量比同时通入品红溶液,能增强其漂白性。
参考答案:C
本题解析:白粉的成分为次氯酸钙和氯化钙,有效成分是次氯酸钙,A不正确。碘化氢具有还原性,能被浓硫酸氧化,B不正确。氯气具有氧化性,SO2具有还原性,二者发生氧化还原反应,生成盐酸和硫酸,漂白性降低。所以选项C是正确的,答案选C。
本题难度:一般
3、计算题 (8分)在加热条件下,用MnO2与足量浓盐酸反 应,制得氯气0.56L(标准状况)。问:
应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
参考答案:(1)需耗MnO2?2.18g??(4分)(2)被氧化的HC
本题解析:略
本题难度:一般
4、选择题 如右图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入一定量氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原来试管中盛装的气体判断不正确的是(???)
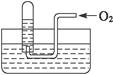
A.可能是空气与NO2的混合气体
B.可能是O2与NO2的混合气体
C.可能是NO与NO2的混合气体
D.可能是NO2一种气体
参考答案:A
本题解析:因为空气中的N2不溶于水,通常情况下,也不与O2和水发生反应,最后肯定剩余在试管中,这样试管内就不可能完全被水充满。
本题难度:简单
5、选择题 下列关于氯水的叙述中,正确的是
A.新制的氯水盛放在棕色瓶中,放置于阴凉处
B.新制的氯水中含有氯气分子,氯分子可以杀菌、消毒
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性减弱
参考答案:A
本题解析:略
本题难度:一般