微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 22、某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。

| 实验现象
| 结论及解释
|
①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液
| 未见明显现象
| 原因:
???????????????????。
|
②点燃A、G处酒精灯
| 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色??????,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化
| 烧瓶中发生的所有反应
的化学方程式:
?????????????????????????
?????????????????????????
说明产生的SO2气体完全被D中溶液吸收
填完上述实验报告并回答下列问题:
(1)连接好装置后,盛放药品前,首先要进行??????????????????????操作。
(2)装置D的作用是?????????????????????????,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用??????????(填编号)代替
A、蒸馏水?????? B、浓硫酸?????? C、浓NaOH溶液???? D、饱和NaHSO3溶液
(3)装置F中的溶液是???????????????,装置H的作用是:????????????????????????????????????
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行???????????、?????????????、干燥、称量。为判断沉淀完全,应该进行的操作是:??????????????????????????????????????????????????。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
???????????????????????????L(列出计算式即可)
参考答案:
实验步骤
实验现象
结论及解释
?
本题解析:实验目的为了研究铁与浓硫酸的反应并检验产物,第一次用品红溶液检验SO2酸性高锰酸钾为了除去SO2,第二次用品红是检验SO2是否除尽,防止干扰CO2的检验。
本题难度:一般
2、选择题 下列说法不正确的是[???? ]
A.假说经过反复验证和修正,才发展成为科学的理论
B.模型一般可分为物体模型和思维模型
C.研究物质的性质常用观察、实验、分类、比较等方法
D.科学实验能解决化学学科的所有问题
参考答案:D
本题解析:
本题难度:简单
3、选择题 通过量CO2于下列溶液中,出现浑浊的是( )
A.Ba(NO3)2溶液
B.澄清石灰水
C.Na2SiO3溶液
D.饱和Na2CO3溶液
参考答案:CD
本题解析:
本题难度:简单
4、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2??(1)
平均反应速率的计算式为v(S2O82-)=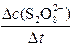 。 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-??(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实?验?编?号
| ①
| ②
| ③
| ④
| ⑤
| ?
试剂
用量
(mL)
| 0.20? mol·L-1(NH4)2S2O8溶液
| 20.0
| 10.0
| ?b
| 20.0
| 20.0
| 0.20? mol·L-1 KI溶液
| 20.0
| 20.0
| 20.0
| 10.0
| 5.0
| 0.010? mol·L-1 Na2S2O3溶液
| ?a
| 8.0
| 8.0
| 8.0
| 8.0
| 0.2% 淀粉溶液
| 2.0
| 2.0
| 2.0
| 2.0
| 2.0
| 0.20? mol·L-1KNO3溶液
| 0
| 0
| 0
| 10.0
| ?c
| 0.20? mol·L-1(NH4)2SO4溶液
| 0
| 10.0
| 15.0
| 0
| 0
| 20 ℃时,反应时间Δt(s)
| 32
| 67
| 130
| 66
| 135
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
|
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是??????????。
(3)第①组实验的v(S2O82-)=????????????????????mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)?????????????????????
???????????????????????????????????????????????????????????????????????????。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
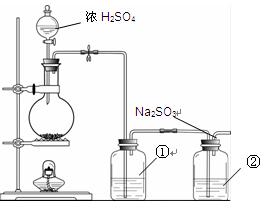
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①????????????????????????????????;
②????????????????????????????????。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是?????????????????????????????????????????????。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:???????????????????????????????????????????????????????????????????。
参考答案:(13分)
I(1)a? 8.0?(1分)?????
本题解析:略
本题难度:简单
5、实验题 铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
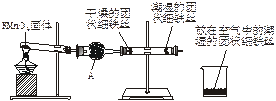
图11-21
首先检查制氧装置的气密性,然后按图11-21连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_________。能表示其原理的反应方程式为___________________________。
(2)仪器A的名称为_________,其中装的药品可以是_________,其作用是_________。
(3)由实验可知,该类铁生锈的条件为_________。决定铁生锈快慢的一个重要因素是_________。
参考答案:(1)电化学腐蚀(1分)
负极:Fe-2e-====F
本题解析:钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直形管中的现象说明,潮湿是铁生锈的必要前提,而没有涉及潮湿程度对生锈快慢的影响,直形管实验与烧杯实验的对比,则说明O2浓度是影响生锈快慢的一个重要因素。
本题难度:一般
|