微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)
I、为了探究HClO的漂白性,某同学设计了如下的实验。
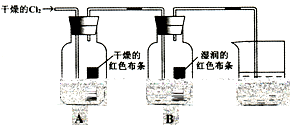
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是???????。
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是______________。
(3)烧杯中发生反应的化学方程式是_________________________________。
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于?????????。
(2)某次采集的硫酸工业产区酸雨样品,每隔一段时间测定一次pH值,得数据如下
时间
| 开始
| 8h后
| 16h后
| 24h后
| 32h后
| 40h后
| 48h后
|
pH
| 5.0
| 4.8
| 4.6
| 4.3
| 4.2
| 4.0
| 4.0
酸雨样品pH值变小的主要原因是_____________________________。
2、实验题 某品牌消毒液包装说明的部分内容摘录如下:主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
1.阅读材料,获取信息
⑴推测该消毒液的酸碱性:????????????????,原因是(用离子方程式表示)??????????????。
⑵该消毒液还具有的化学性质是?????????性和???????????性。
⑶从该消毒液的保存要求分析,导致其失效的外界因素主要是?????????????????。
2.确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
3.设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;假设②:无明显现象。
⑷基于假设①,结论是铁钉被腐蚀,预期的实验现象是???????????????????????。
⑸基于假设②,结论是???????????????,请设计实验进一步验证该结论,叙述实验操作:??????????????。
3、实验题 一般的易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。本次实验选取可口可乐公司生产的雪碧汽水易拉罐作为探究的对象。
提出假设:易拉罐的主要成分是铝和铁。
探究过程及现象:
1.配制6 mol/L氢氧化钠溶液和6 mol/L的盐酸。
2.将易拉罐剪开,用砂纸打磨使表面油漆和氧化膜去掉,再剪取一小块进行实验。
实验一:用胶头滴管向装有铝合金的大试管中加入足量的氢氧化钠溶液,可以看到有气泡生成,反应一段时间后,溶液中还有不溶物。
实验二:用滴管继续向实验一的试管中逐滴加入6 mol/L的盐酸至足量,静置24小时。
按实验顺序,该同学记录的现象如下:①开始没有明显现象;②有白色絮状沉淀生成;③白色沉淀消失;④原溶液中不溶物完全溶解,此时溶液呈浅绿色;⑤静置24小时后,溶液呈棕黄色。
实验三:再向该试管中加入一定量的氢氧化钠溶液,最终只得到红棕色沉淀。
请回答下列问题:
(1)实验一反应的化学方程式__________________________________________。
(2)实验二所得溶液为什么静置24小时后由浅绿色变为棕黄色
_______________________________________________________________________。
(3)写出实验二中产生①、②现象的反应离子方程式:__________________________,
____________________________________。
(4)由此可知该假设_____________(填“成立”,“不成立”或“无法确定”)。
4、选择题 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( ????)
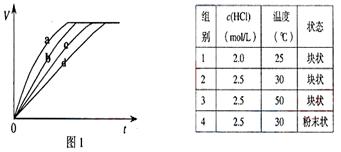
A.3-4-1-2
B.1-2-4-3
C.4-2-3-1
D.3-4-2-1
5、实验题 (14分)某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是??????????,其作用是??????????。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是?????????????????????。B中应放置的液体是??????????(填字母)。
a.水 b.酸性KMnO4????????????????????????????c.浓溴水???????????????????????????? d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热, 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是??????????
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是??????????(填字母)。
a.铁粉?????????????????????????????????????????? b.银粉????????????????????????????????? c.碳酸氢钠溶液?????????????? d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
??????????(填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
|