10.8
?
过程②中加氨水调节溶液的pH等于6,则滤渣B的成分??????????????????。
(4)浸出液中以Mn2+形式存在,且滤渣A中无MnO2原因?????????????????????????。
(5)电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的???????极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为?????????????????????????????????????????。
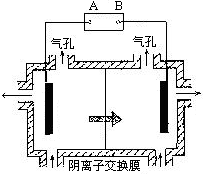
(6)滤渣经反应④生成绿色高效水处理剂的离子方程式 ??????????????????????????????????????????。
K2FeO4被誉为绿色高效水处理剂的原因是??????????????????????????????????????????。
参考答案:(1)①粉碎红帘石(1分)?②提高反应的温度(其他答案合理也
本题解析:
试题分析:(1)增大接触面积、提高温度可以提高反应速率,所以粉碎红帘石、提高反应的温度可以提高稀硫酸浸取效率。
(2)根据原子守恒和化合价不变,可写出氧化物表达式:3MgO·3SiO2·2H2O。
(3)根据表中所给数据,pH=6时,Fe3+、Al3+完全沉淀,所以滤渣B的成分为Fe(OH)3和Al(OH)3。
(4)MnO2具有氧化性,所以MnO2在酸性条件下被二价铁还原为Mn2+。
(5)电解时,电解质溶液中阴离子移向阳极,所以电极B为直流电源的正极,则A电极是直流电源
本题难度:困难
2、填空题 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。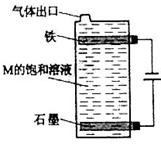
参考答案:(1)  本题解析: 本题解析:
试题分析:根据丙、丁、戊处于同一周期,且丙、丁、戊的最高价氧化物的水化物之间都能发生反应,可知丁为Al,该三种元素处于第三周期,氢氧化铝能够与强碱和强酸反应,结合题意,原子序数依次增大的短周期主族元素,推出丙为Na,戊为S,己为Cl;根据乙元素最高化合价与最低价的代数和为0,乙为C元素,甲、丙处于同一主族,甲为H元素。(1)氢的阴离子最外层有2个电子,碳和硫之间以共价键形成CS2;(2)根据电子层数越多半径越大,电子层排布相同的离子,离子半径大小与核电荷数大小成反比,即S2->Na+>Al3+ ,氢化物的还原性与非金属性成反比例,非金属性越强,其氢化物的还原性越弱,其还原性顺序:H2S>CH4>HCl;(3)甲、乙两元素形成的化合物属于烃类,含有极性键又含有非极性键,且相对分子质量最小的物质,含2个碳,含H个数最少,综合判断为乙炔,结构简式为:H-C≡C-H ,乙炔燃料电池,负极是乙炔失去电子发生氧化反应,酸性条件下电极反应式为: C2H2 + 4H2O ? 10e-= 2CO2+10H+;(4)氢氧化钠与氢氧化铝反应离子方程式为Al(OH)3+OH- =AlO2- +2H2O ,H、Na、S、Cl形成的化合物,应该是硫化物(H2S、NaHS或Na2S)和氯化物(HCl和NaCl),其中能发生反应的是NaHS+HCl= NaCl+H2S或Na2S + H 2S =2 NaHS;(5)电解饱和氯化钠溶液,阳极在装置的下部,阳极反应生成的氯气往上溢出的过程中与阴极附近的氢氧化钠反应生成次氯酸钠,起到消毒作用,总电解反应为NaCl+H2O NaClO+H2↑。 NaClO+H2↑。
考点:元素周期律、离子方程式书写、电解池反应原理知识。
本题难度:困难
3、选择题 科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺——TiO2直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。下列说法错误的是?????? ( )
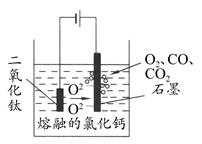
A.阴极得到钛,电极反应式为TiO2+4e-=Ti+2O2-
B.阳极的电极反应式是2O2--4e-=O2↑,生成的部分氧气会将石墨氧化成CO和CO2
C.在工业生产过程中应该不断地更换两极材料
D.该法生产Ti符合绿色环保的要求
参考答案:D
本题解析:根据图像可知阴、阳两极发生的反应;由于TiO2和石墨不断被消耗,故应该不断地更换两极材料;由于消耗较多的能量,且产生污染性气体,故该法不符合绿色环保的要求,D错。
本题难度:一般
4、选择题 用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入 [???? ]
A.Cu(OH)?2??? ??
B.Cu???? ?
C.CuSO4???? ?
D.CuO?
参考答案:D
本题解析:
本题难度:一般
5、简答题 工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的______通过.(填下列微粒的编号)
①H2②Cl2③H+④Cl-⑤Na+⑥OH-
(2)写出在电解过程中阳极发生的电极方程式:______.
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为______.
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:
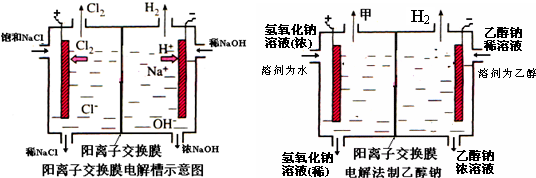
①写出在电解过程中阴极发生的电极方程式______.
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:______.
参考答案:(1)阳离子交换膜只允许阳离子钠离子、氢离子通过,而阴离子和
本题解析:
本题难度:一般
|