微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2(g)+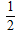 O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是( )
O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是( )
A.H2的燃烧热为285.8?kJ/mol
B.2H2(g)+O2(g)═2H2O(l)△H=-571.6?kJ/mol
C.1?mol?H2完全燃烧生成气态水放出的热量大于285.8?kJ
D.形成1?mol?H2O的化学键释放的总能量大于断裂1?mol?H2和0.5?mol?O2?的化学键所吸收的总能量
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知:O2(g) = O2+(g)+e-  H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1
PtF6-(g) =PtF6(g)+e-  H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1
O2+(g)+PtF6-(g) =O2PtF6(S)  H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1
则反应O2(g)+PtF6(g) = O2PtF6 (s)的 H是( )
H是( )
A.77.6 kJ
B.-77.6 kJ·mol-1
C.+77.6kJ·mol-1
D.-886.8kJ·mol-1
参考答案:B
本题解析:运用盖斯定律,将O2(g) = O2+(g)+e- H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1
PtF6-(g) =PtF6(g)+e- H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1
O2+(g)+PtF6-(g) =O2PtF6(S)  H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1
三个热化学反应方程式叠加,可得:O2(g)+PtF6(g) = O2PtF6 (s) H= -77.6 kJ·mol-1
H= -77.6 kJ·mol-1
本题难度:简单
3、选择题 已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
参考答案:C
本题解析:
试题分析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g) △H2,③2CO(g)+O2(g)=2CO2(g) △H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s) △H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3=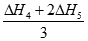 ,D错误,答案选C.
,D错误,答案选C.
考点:盖斯定律
本题难度:一般
4、选择题 在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,下列热化学方程正 确的是 [???? ]
A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452KJ/mol
C.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-725.8KJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1452KJ/mol
参考答案:B
本题解析:
本题难度:简单
5、填空题 2SO2(g)+O2(g)=2SO3(g) 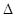 H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题:
H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题:
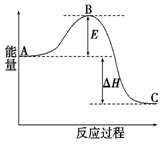
⑴E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;
⑵图中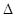 H= kJ·mol-1;
H= kJ·mol-1;
⑶如果反应速率v(SO2)为0.05 mol·L-1·min-1则v(O2)= mol·L-1·min-1;
v(SO3)= mol·L-1·min-1;
参考答案:(1)无 降低 (2) -
本题解析:(1)E表示反应的活化能,活化能的大小与反应热大小无关系。催化剂钠降低反应的活化能,所以使用催化剂后B点是降低的。
(2)图中△H表示该反应的反应热,等于-198kJ/mol。
(3)由于反应速率之比是相应的化学计量数之比,所以v(O2)=v(SO2)/2=0.025mol·L-1·min-1,v(SO3)=v(SO2)=0.05 mol·L-1·min-1。
本题难度:一般