微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ____ ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
参考答案:(1) 434 kJ/mol (2分)
(2
本题解析:
试题分析:(1) 化学反应中放出的热能(焓变,ΔH)等于反应物的总键能之和与生成物的键能(E)之各的差值,计算出则E(H-Cl)=434 kJ/mol;(2) 假设三个方程式分别为:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol;②3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol; ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol;根据盖斯定律,FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=? kJ/mol,可以求出ΔH=【①*3-②-③*2】/3=-11 kJ/mol;(3)①①电池的正极要发生得电子反应,故反应式为O2+4e-=2O2- ②在原电池中阴离子向负极移动;
考点:本题考查盖斯定律的应用和原电池电极反应式的书写。
本题难度:困难
2、填空题 用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为______,写出上述反应的热化学方程式:______.
参考答案:已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g
本题解析:
本题难度:一般
3、填空题 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: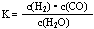 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃
| 400
| 500
| 800
|
平衡常数K
| 9.94
| 9
| 1
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应 N2O4(g) 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
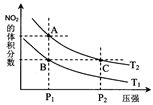
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
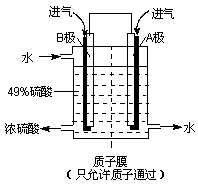
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
参考答案: (1) C(s)+H2O(g)  本题解析: 本题解析:
试题分析:(1)煤生成水煤气的反应为C(s)+H2O(g)  CO(g)+ H2 (g)。 CO(g)+ H2 (g)。
(2)观察目标方程式,应是①2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ? mol -1;负极以CH3OCH3和H2O作为原料,失去电子生成CO2和 H+
(3)升高温度,平衡常数减小,平衡左移,故正反应是放热反应;
CO(g)+H2O(g)?CO2(g)+H2(g) 反应是一定体积容器中设为1L,反应量为x
起始量(mol) 0.02 0.02 0 0
变化量(mol) x x x x
所得量(mol)0.02-x 0.02-x x x
根据K= c(CO2) ×c(H2)/( c(CO) × c(H2O) ),得 x2/(0.02-x)2=9,得x=0.015mol
转化率为0.015/0.02×100%=75%
(4)A、从A点到C点,温度相同,但是P2>P1,压强大,化学反应速率快,因此C>A
B、C点的压强大,容器体积小,浓度高,因此C点颜色深。
C、B,C两点的纵坐标数据相同,也就是各气体的体积分数相同,物质的量相同,其平均相对分子质量也相同
D、 该反应为吸热反应(可视为N2O4(g)=NO2(g)+NO2(g),为分解反应,吸热过程)。B到A的过程生产物NO2(g)的体积分数增多,反应正向移动,可以采用加热的方法。
(5)滴加氨水的过程中,将抑制水的电离。理由是加碱将抑制水的电离,故水的电离平衡将 逆向
.由电荷守恒得:n(NH4+) +n(H+)=n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= n(OH-),n(NH4+) =n(NO3-) =m
NH3H2O=(可逆)=NH4+ +OH-
X m /n 10-7
NH3H2O的店里平衡常数 Kb="c(" NH4+)×c( OH-)/C(NH3H2O)="[" ( m/n )×10-7 ]/x=2×10-5mol·L-1
所以x= m/200n mol·L-1
(6) 阳离子向正极移动,所以H+从B极向A极移动。
根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
考点:考查化学平衡知识
本题难度:困难
4、填空题 (15分)研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
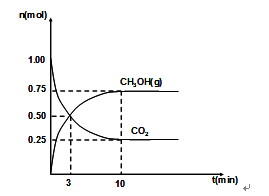
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
A.使用更有效的催化剂
B.在原容器中再充入1mol CO2
C.在原容器中再充入1mol He
D.缩小容器的体积
E、将甲醇及时分离出来
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
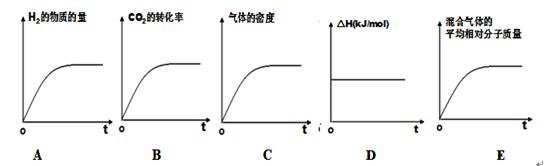
④该条件下,此反应的化学平衡常数为 。
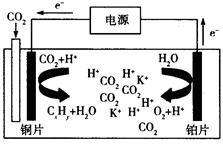
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
化学式
| 电离平衡常数
| HCN
| K=4.9×10-10
| H2CO3
| K1=4.3×10-7、K2=5.6×10-11
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
参考答案:(15分).
(1)CO2(g)+3H2(g)=CH3
本题解析:
试题分析:(1)甲醇燃烧的热化学方程式是CH3OH(l)+3/2O2(g)= CO2(g)+ 2H2O(l) ΔH= -726.5kJ/mol,氢气燃烧的热化学方程式是H2(g)+1/2O2(g)= H2O(l) ΔH= -285.8kJ/mol,根据盖斯定律,将氧气消去,下式乘以3减去上式可得氢气与二氧化碳反应生成甲醇的热化学方程式,答案为CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol;
(2)①从反应开始到3min时,甲醇的物质的量增加0.50mol,则水蒸气的物质的量也增加0.50mol,所以H2O(g)的平均反应速率是0.50mol/4L/3min="0.042" mol/(l·min);
②A、使用催化剂,只能加快反应速率,不能改变平衡,所以氢气的转化率不变,错误;B、在原容器中再充入1mol CO2,则反应物的浓度增大,反应速率加快,同时平衡正向移动,则氢气的转化率增大,正确;C、在原容器中再充入1mol He,则容器的压强增大,但各物质的浓度不变,反应速率和平衡都不变,错误;D、缩小容器的体积,则压强增大,反应速率加快,同时平衡正向移动,氢气的转化率增大,正确,答案选BD;
③A、氢气的起始物质的量不是0,与题意不符,错误;B、二氧化碳的转化率逐渐增大,达到平衡时,不再增大,正确;C、因为是恒容条件,气体的密度始终不变,不能判断为平衡状态,错误;D、一个化学反应的反应热只与反应物与生成物的状态有关,所以反应热始终不变,错误;E、该反应是气体的物质的量发生变化的可逆反应,所以气体的平均相对分子质量也发生变化,达到平衡时,不再变化,正确,答案选BE;
④根据图像可知,平衡时甲醇的物质的量是0.75mol,二氧化碳的物质的量是0.25mol,则水蒸气的物质的量是0.75mol,氢气的物质的量是3.25-0.75×3=1mol,根据平衡常数的定义,则该条件下的平衡常数K=(0.75/4)2/(1/4))30.25/4=36;
(3)根据电子的移动方向可知,铜极为阴极,铂极为阳极,阴极是二氧化碳得到电子与氢离子结合为乙烯和水,阳极是水失去电子,生成氧气和氢离子,所以总反应是二氧化碳与水反应生成乙烯和氧气,化学方程式是2CO2+ 2H2O =C2H4+3O2;
(4)①因为HCN的电离常数K=4.9×10-10=c(H+) c(CN-)/ c(HCN),pH=11,则c(H+)=10-11mol/L,则c(HCN)/c(CN-)= c(H+)/K=2.0×10-2;
②向NaCN溶液中通入少量CO2,根据表中酸的电离常数可知,酸性:H2CO3>HCN>HCO3-,所以NaCN和碳酸氢钠,不会再生成碳酸钠和HCN,则反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
考点:考查盖斯定律的应用,化学平衡状态的判断,化学平衡移动的应用,电离常数的应用
本题难度:困难
5、选择题 下列说法正确的是
A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1
C.对于可逆反应N2(g)+3H2(g) 2NH3(g)△H 2NH3(g)△H
参考答案:
本题解析:
本题难度:一般
|
|