微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是 [???? ]
A.1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为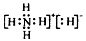
D.它与水反应的离子方程式为NH4++ H-+ H2O = NH3·H2O + H2↑
参考答案:A
本题解析:
本题难度:一般
2、选择题 SiCl4的分子结构与CCl4类似,对其作出如下判断:①SiCl4晶体是分子组成的晶体?②常温、常压下SiCl4是液体?③SiCl4的分子是由极性键组成的非极性分子?④SiCl4熔点高于CCl4。其中正确的是(??? )
A.只有①②③
B.只有①②
C.只有②③
D.①②③④
参考答案:D
本题解析:CCl4是非极性分子,其晶体是由分子组成的晶体。由于SiCl4的分子结构与CCl4类似,且SiCl4的相对分子质量比CCl4大,故SiCl4晶体是由分子组成的晶体。SiCl4的分子是由极性键形成的非极性分子;SiCl4熔点高于CCl4,常温、常压下SiCl4是液体。
本题难度:简单
3、选择题 下列分子中,杂化类型相同,空间构型也相同的是( )
A.H2O、SO2
B.BeCl2、CO2
C.H2O、NH3
D.NH3、CH2O
参考答案:B
本题解析:
试题分析:根据价层电子对互斥理论可知,水中O原子含有的孤对电子对数=(6-2×1)÷2=2,采取 sp3杂化方式,水是V型结构。SO2中S原子含有的孤对电子对数=(6-2×2)÷1,采取 sp2杂化方式,SO2是V形结构,故A不正确;同样分析氯化铍中Be原子是sp杂化,是直线型结构。CO2是直线型结构,碳原子是sp杂化,B正确;氨气中氮原子是sp3杂化,含有1对孤对电子,因此氨气是三角锥形结构,C不正确;甲醛中碳原子是sp2杂化,属于平面型结构,D不正确,答案选B。
点评:该题是高考中的常见
本题难度:一般
4、选择题 1824年法国巴拉尔发现溴。在他以前,有一家工厂曾将一瓶红棕色的液体送给德国化学家李比希检测,李比希凭经验武断地认为该液体为氯化碘(化学式为ICl,性质和溴非常相似)。后来看到巴拉尔发现溴的报道后,忏悔不已。下列关于ICl的有关说法中不正确的是(??? )
A.I—Cl键为极性共价键
B.ICl分子为共价化合物分子
C.该物质在反应中通常体现氧化性
D.在反应ICl+2NaOH====NaCl+NaIO+H2O中作氧化剂
参考答案:D
本题解析:由于ICl性质和Br2相似,Br2在反应中通常作氧化剂(包括在与氢氧化钠反应中),因此该物质在反应中通常做氧化剂,呈现氧化性。但应该注意在ICl+2NaOH="===NaCl+" NaIO+H2O反应中,ICl各种元素的化合价并没有改变,因此不是氧化剂。因此本题答案为D项。卤素互化物(如ICl)性质和卤素单质相似,但它们是化合物。ICl中各元素的化合价分别为+1和-1价。
本题难度:简单
5、选择题 X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是( )
| X | | ????Y
Z
W
A.X、Y、Z、W均为非金属元素
B.X、Y、W的氢化物中,Y的氢化物沸点最高
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的简单离子半径大于Z元素的简单离子半径
参考答案:因短周期中的位置为二、三周期,设Y的质子数为x,则X的质子数
本题解析:
本题难度:简单
|