微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如右图所示,向一定量的铁粉中加入一定体积12 mol·L-1的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是(???)
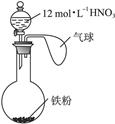
①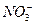 ? ②Fe3+? ③H+? ④NO? ⑤NO2
? ②Fe3+? ③H+? ④NO? ⑤NO2
A.只有①
B.①⑤
C.②④⑤
D.①②③⑤
参考答案:B
本题解析:题中给出的12 mol·L-1的硝酸是浓硝酸,如果铁少则生成Fe3+,如果铁过量则生成Fe2+,溶液中一定有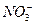 ,烧瓶中的气体一定有NO2。
,烧瓶中的气体一定有NO2。
本题难度:简单
2、选择题 下面各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积
B.相同温度下,0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)
C.常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-)
D.铜与浓硫酸共热反应中,消耗的Cu与被还原的H2SO4的物质的量
参考答案:C
本题解析:
正确答案:C
A.不正确,滴定管最下端还有一段无刻度;
B.不正确,相同温度下,醋酸溶液浓度越稀,电离程度越大;
C.正确,常温下,氨水与(NH4)2SO4的混合溶液pH=7时,由电荷守恒,c(NH4+)+c(H+)= c(OH― )+2c(SO42-),c(NH4+)=2c(SO42-)
D.不正确,铜与浓硫酸共热反应中,消耗的Cu与被还原的H2SO4的物质的量1:1
本题难度:一般
3、计算题 草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为:?????;
预期现象是:
①溶液的颜色由?????色变为?????色,
②其中加入?????mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
实验
编号
| A(KMnO4溶液浓度/mol·L-1)
| B(草酸溶液浓度/mol·L-1)
| C(硫酸溶液浓度/mol·L-1)
| 褪色时间/s
|
1
| 3
| 3
| 1
| 336
|
2
| 1
| 2
| 3
| 82
|
3
| 3
| 1
| 3
| 76
|
4
| 1
| 3
| 2
| 133
|
5
| 2
| 3
| 3
| 102
|
6
| 3
| 2
| 2
| 156
|
7
| 2
| 2
| 1
| 300
|
8
| 2
| 1
| 2
| 115
|
9
| 1
| 1
| 1
| 200
|
?
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
?
| A(KMnO4溶液)
| B(草酸溶液)
| C(硫酸溶液)
|
浓度/mol·L-1
| 0.005
| 0.010
| 0.015
| 0.1
| 0.5
| 0.9
| 6
| 12
| 18
|
平均褪色时间/s
| 138.3
| 172.3
| 189.3
| 130.3
| 179.3
| 190.3
| 278.7
| 134.7
| 86.7
|
?
(2)由表2可知,三因素中,?????的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而?????的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为?????mol·L-1、草酸浓度为?????mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
c(H2SO4)/mol·L-1
| 18
| 16
| 14
| 12
| 10
| 8
| 6
|
褪色时间/s
| 67
| 83
| 90
| 103
| 129
| 146
| 200
|
?
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为?????mol·L-1和?????mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
参考答案:(14分)
(1)2MnO4-+5H2C2O4+6H+
本题解析:
试题分析:
(1)高锰酸钾具有氧化性、草酸具有还原性,MnO4-将H2C2O4氧化为CO2气体,本身被还原为Mn2+,根据得失电子相等、电荷守恒、质量守恒配平。MnO4-呈紫色,反应后溶液为无色。增大反应物浓度,反应速率加快。
(2)由表2可知,硫酸浓度对反应速率影响显著;而高锰酸钾和草酸浓度对反应速率 影响不明显。
(3)当高锰酸钾溶液浓度为0.005 mol·L-1、草酸溶液浓度为0.01 mol·L-1时反应速率最快。
(4)褪色时间1分钟和2分钟即60s和120s,对应的浓度分别为18 mol·L-1和10 mol·L-1。
本题难度:一般
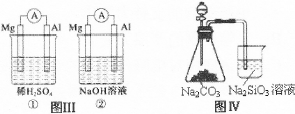
4、选择题 下列叙述正确的是

A.图I装置中通入N2和O2的作用是相同的
B.图Ⅱ中甲、乙两装置产生喷泉的原理一样
C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极
D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si
参考答案:C
本题解析:
试题分析:A、O2发生还原反应,而N2不参加负极反应,错误;B、氨气溶于水,H2O2分解产生大量O2,错误;C、Mg比Al易与稀硫酸反应,则①中Mg是负极,Al才能与NaOH溶液反应,则②中Al是负极,正确;D、硝酸具有挥发性,因此不能证明非金属性N>C>Si,错误。
本题难度:一般
5、选择题 下列有关实验的操作、原理和现象,正确的是(???)
A.减压过滤是为了加快过滤速度,得到较大颗粒的晶体
B.硫酸亚铁铵晶体过滤后用无水乙醇洗涤除去其表面的杂质
C.溶液、胶体各悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜
D.用Na2SO4的稀溶液使蛋清液发生盐析,进而分离、提纯蛋白质
参考答案:B
本题解析:
试题分析:A项:减压过滤只是为了加快过滤速度,与晶体大小无关;C项:溶液、胶体各悬浊液这三种分散系的本质区别微粒直径大小不同;D项:用饱和的Na2SO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质。故选B。
点评:考查内容较多,涉及蛋白质性质、胶体、硫酸亚铁铵晶体、比较简单,旨在考查学生对基础知识的掌握,平时注意基础知识的积累掌握。
本题难度:简单