微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2 + 2Na+ +2OH-=Na2SiO3↓+ H2O
C.向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
参考答案:C
本题解析:
试题分析:A.铜与稀硝酸反应生成NO,故A错误;B.硅酸钠是可以溶于水的物质,应该拆成离子形式,故B错误;C.正确,故选C;D.醋酸是弱酸,不能拆成离子形式,故D错误。
考点:离子方程式的书写。
本题难度:一般
2、填空题 (15分)写出符合以下离子方程式的化学方程式各1个
(1)Zn+Cu2+=Zn2++Cu
(2)H++OH-=H2O
参考答案:(1)Zn+CuSO4=ZnSO4+Cu;(2)HCl+Na
本题解析:
试题分析:(1)表示锌与可溶性铜盐(如氯化铜、硝酸铜、硫酸铜等)反应生成可溶性锌盐和铜;
(2)强酸(如盐酸、硫酸、硝酸等)和可溶性强碱(氢氧化钾、氢氧化钠等)反应生成水和可溶性盐。
考点:考查离子方程式表示的意义。
点评:离子方程式不仅表示一个反应,还可以表示一类反应,本题属于较简单题。
本题难度:一般
3、选择题 在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
AA
| 向FeCl2溶液中滴入氯水
2Fe2++ Cl2= 2Fe3++ 2Cl—
| 向FeCl2溶液中滴入碘水
2Fe2++ I2= 2Fe3++2I—
|
B
| CO2通入漂白粉溶液中
CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO
| SO2通入漂白粉溶液中
SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO
|
C
| 向Na2CO3溶液中滴入稀HNO3
CO32—+ 2H+ = CO2↑+ H2O
| 向Na2SO3溶液中滴入稀HNO3
SO32— +2H+ = SO2↑+H2O
|
D
| 向澄清石灰水中通入少量CO2气体
Ca2++2OH— +CO2= CaCO3↓+ H2O
| 向澄清石灰水中通入少量SO2气体
Ca2++2OH— +SO2= CaSO3↓+H2O
参考答案:D
本题解析:
试题解析:A.FeCl2溶液与碘水不反应,则前者发生氧化还原反应,后者不反应,与氧化性有关,故A错误;
B.SO2通入漂白粉溶液,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应为2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故C错误;
D.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水,则类推合理,故D正确。
考点:离子方程式的书写
本题难度:困难
4、实验题 (14分)下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
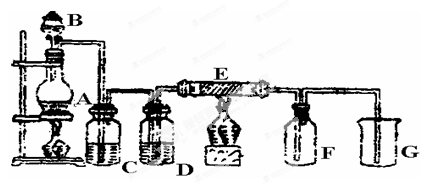
(1)A中发生的化学反应的离子方程式为 。
(2)C中盛装的药品__________;
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2与SO2等物质的量通入水中则无漂白作用,试写出化学方程式 。
(6)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①当有0.2mole-转移时被氧化的HCl的质量是 ;
②如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将 。
A.≥1.68L
B.>1.68L
C.≤1.68L
D.<1.68L
参考答案:(1)MnO2+4H++2Cl- 本题解析: 本题解析:
本题难度:困难
5、填空题 【化学——选修2化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
参考答案:(除注明外,每空2分)(1)① 本题解析: 本题解析:
试题分析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据步骤I中反应的化学方程式可知该反应的化学平衡常数的表达式为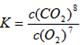 。A.升高温度反应速率加快,A正确;B.通入过量的空气,增大氧气浓度,反应速率加快,B正确;C.将原料粉碎增大反应物的接触面积,反应速率加快;D.纯碱是固体,增加纯碱的用量不能影响反应速率,D错误,答案选ABC。 。A.升高温度反应速率加快,A正确;B.通入过量的空气,增大氧气浓度,反应速率加快,B正确;C.将原料粉碎增大反应物的接触面积,反应速率加快;D.纯碱是固体,增加纯碱的用量不能影响反应速率,D错误,答案选ABC。
②由于溶液显碱性,单质铝与硅均能与氢氧化钠溶液反应,则在碱性溶液中铝和硅的存在形式分别是NaA1O2[或NaA1(OH)4]、Na2SiO3;
③由于溶液中含有偏铝酸钠和硅酸钠等杂质,因此步骤III需将溶液的pH调至7~8并煮沸的目的是除去A1O2-、SiO32-等杂质,以得到纯净的铬酸钠溶液。
④加入硫酸后有重铬酸钠和硫酸钠生成,则步骤Ⅳ中发生反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O。
(2)由于NaCl的溶解度受温度影响小,而K2Cr2O7的溶解度受温度影响大,因此可以利用结晶法除去氯化钠,即基本实验步骤为:①溶解;②蒸发;;③趁热过滤;④冷却、结晶,过滤,得到K2Cr2O7晶体。
考点:考查物质制备工艺流程图的有关分析与判断
本题难度:困难
|