微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LN2中含有的原子数为2NA
B.标准状况下,11.2 L CCl4中含有的分子数为0.5 NA
C.物质的量浓度为1 mol·L-1的K2SO4溶液中,含2 NA个K+
D.23g Na与足量H2O反应转移的电子数为NA
参考答案:AD
本题解析:
试题分析:标准状况下,n(N2)="V÷22.4L/mol=22.4L÷22.4" L/mol =1mol,氮原子个数N=n×NA=1×2×NA=2NA,A对;标准状况下, CCl4是液体,无法计算物质的量,B错;C中没有体积,无法计算,C错;Na与足量H2O反应生成Na+,Na→Na+转移一个电子,23g Na的物质的量为1mol,故反应转移电子数目为NA,D对,选AD。
考点:阿佛加德罗常数和电子转移的有关计算
本题难度:一般
2、选择题 V mL Fe2(SO4)3溶液中含Fe3+m mg,则溶液中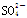 的物质的量浓度为
的物质的量浓度为
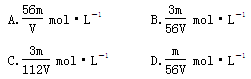
参考答案:C
本题解析:
试题解析:Wg Fe3+的物质的量为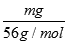 =
=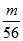 mol,所以n(SO42-)=
mol,所以n(SO42-)= n(Fe3+)=
n(Fe3+)= ×
×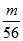 mol=
mol=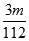 mol,SO42-的物质的量浓度为
mol,SO42-的物质的量浓度为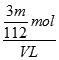 =
= 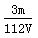 mol·L-1,故选C.
mol·L-1,故选C.
考点:物质的量浓度的有关计算
本题难度:一般
3、计算题 (5分)在标准状况下,2.24L HCl气体的质量为多少,将其溶于水,配成500ml盐酸溶液,所得溶液的H+ 的物质的量浓度?
参考答案:3.65g 0.2mol/L
本题解析:
试题分析:在标准状况下,2.24升气体的物质的量=2.24/22.4=0.1mol,其质量=0.1×36.5=3.65克。物质的量浓度=0.1/0.5=0.2mol/L.
考点:物质的量浓度的计算。
本题难度:一般
4、选择题 核内中子数为N的R2+的质量数为A,则n克它的氧化物所含质子的物质的量是(??? )
A.〔n(A-N+8)/(A+16)〕mol
B.〔n(A-N+16)/(A+16)〕mol
C.〔n(A-N+8)/ A 〕mol
D.〔n(A-N+16)/ A 〕mol
参考答案:A
本题解析:
试题分析:该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为ng/[(A+16)(g/mol)];
一个氧化物分子中含有(A-N+8)个质子,所以ng 它的氧化物中所含质子的物质的量为{ng/[(A+16)(g/mol)]}×(A-N+8)=〔n(A-N+8)/(A+16)〕mol。故选A。
点评:本题考查了质子数、中子数、质量数之间的关系,难度不大,注意质量数在数值上等于其相对原子质量。
本题难度:简单
5、选择题 如果3.2 g XO2中含有0.1 mol的氧原子,则X的相对原子质量为( )
A.32
B.16
C.48
D.8
参考答案:A
本题解析:本题考查物质的量、摩尔质量及构成物质的粒子数之间的关系,可有多种解法。
设X原子的摩尔质量为M,
解法一:关系式法
XO2 — 2O
M+16×2 g 2 mol
3.2 g 0.1 mol
M= ="32" g·mol-1
="32" g·mol-1
解法二:物质的量之比法
n(X)∶n(O)= 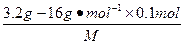 ∶0.1 mol=1∶2
∶0.1 mol=1∶2
M="32" g·mol-1。
解法三:公式法
M==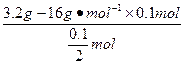 ="32" g·mol-1
="32" g·mol-1
本题难度:一般