微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在a?L?Al2(SO4)3和(NH4)2SO4的混合溶液中加入b?mol?BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c?mol?NH3,则原溶液中的Al3+浓度(mol/L)为[???? ]
A.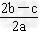
B.
C.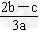
D.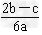
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列溶液中Cl-浓度与50mL?1mol?L-1?AlCl3溶液中Cl-浓度相等的是( )
A.150mL?1.5mol?L-1的NaCl溶液
B.75mL?2mol?L-1的NH4Cl溶液
C.150mL?1mol?L-1的KCl溶液
D.75mL?1mol?L-1的FeCl3溶液
参考答案:50mL?1mol?L-1?AlCl3溶液中Cl-浓度为3m
本题解析:
本题难度:简单
3、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.6.8g熔融的KHSO4中含有0.05NA个阴离子
B.1.0L 1mol/L的NaOH水溶液中含有的氧原子数目为NA
C.25 ℃时,pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
D.5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA
参考答案:A
本题解析:
试题分析:A、6.8g硫酸氢钾的物质的量是0.05mol,其中的阴离子是硫酸氢根离子,所以阴离子数目是0.05NA,正确;B、1.0L1mol/L氢氧化钠溶液中NaOH的物质的量是1mol,但溶液中还存在大量的水,水中含有O元素,所以该溶液中含有的O原子的数目大于NA,错误;C、25 ℃时,pH=13的氢氧化钡溶液中氢氧根离子的浓度为0.1mol/L,但溶液的体积未知,所以氢氧根离子的数目无法计算,错误;D、5.6g铁的物质的量是0.1mol,一定量的硝酸的物质的量未知,则Fe对应的产物是亚铁离子还是铁离子,还是二者均有,无法判断,所以转移电子的数目无法判断,错误,答案选A。
考点:考查阿伏伽德罗常数与微粒数的关系
本题难度:一般
4、选择题 与100mL 0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A.10mL 1mol/L (NH4)2SO4溶液
B.50mL 0.2mol/L NH4Cl溶液
C.10mL 0.2mol/L(NH4)2SO4溶液
D.200mL 0.1mol/L NH4NO3溶液
参考答案:B
本题解析:
试题分析:根据硫酸铵的化学式可知,溶液中NH4+离子浓度是0.1mol/l×2=0.2mol/L。根据选项中的化学式可知,四个选项中NH4+离子浓度分别是(mol/L)2、0.2、0.4、0.1,答案选B。
考点:考查物质的量浓度的有关计算
点评:该类型的试题在判断时,关键是分析电解质的组成及其强弱。另外还需要注意的是,判断的是离子的浓度,还是离子的物质的量,因为物质的量还与溶液体积有关系。
本题难度:一般
5、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1 时,三种溶液中Cl—的物质的量之比为
A.1∶1∶1
B.1∶2∶3
C.3∶2∶1
D.3∶4∶3
参考答案:D
本题解析:
试题分析:NaCl、MgCl2、AlCl3三种溶液物质的量浓度相同,体积比为3∶2∶1时,三种溶液中Cl—的物质的量之比为3×1∶2×2∶1×3=3∶4∶3。所以正确选项为D。
考点:考查溶质的浓度与电离产生的离子的浓度的关系的知识。
本题难度:一般