微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在核磁共振氢谱中出现两组峰,其氢原子数之比为3?:2的化合物是[???? ]
A.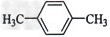 ??????????????????
??????????????????
B.CH3COOCH3??????
C.2-氯丙烷????
D.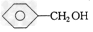 ??
??
参考答案:A
本题解析:
本题难度:一般
2、选择题 以NA表示阿伏加德罗常数,下列说法中正确的是
A.标准状态下,2.24L氯气与足量水充分反应,转移电子的数目为0.1NA
B.常温常压下,1.6g甲醇与肼(N2H4)的混合物中含有电子的数目为0.9NA
C.2.9g熟石膏(2CaSO4?H2O)含有的结晶水分子数为0.02NA
D.在含有NA个CH3COO-的醋酸溶液中,H+数目为NA
参考答案:B
本题解析:分析:A.氯气与水反应是可逆反应;
B.甲醇与肼的摩尔质量相等,含有电子的数相等;
C.质量换算物质的量结合化学式计算;
D.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中存在水的电离.
解答:A.因为氯气和水反应是可逆的,所以无法完全进行,因此标准状态下,2.24L氯气与足量水充分反应,转移电子少于0.1mol即少于0.1NA,故A错误;
B.1mol甲醇含有18mol电子,1mol肼(N2H4)含有18mol电子,甲醇与肼的摩尔质量相等都为32g/mol,所以常温常压下,1.6g甲醇与肼(N2H4)的混合物为0.05mol,含有的电子数为0.9NA,故B正确;
C.2.9g 2CaSO4?H2O物质的量? n=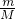 =
= =0.01mol,含有的结晶水分子数为0.01NA;故C错误;
=0.01mol,含有的结晶水分子数为0.01NA;故C错误;
D.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,存在水的电离,氢离子数目大于NA,故D错误;
故选B.
点评:本题主要考查了阿伏伽德罗常数的应用,关键答题时正确计算微粒的物质的量,仔细分析微粒间的数量关系,题目难度不大.
本题难度:困难
3、选择题 比较1.0mol?N2和1.0mol?CO的下列物理量:①质量?②分子总数?③原子总数,其中相同的是
A.①③
B.①②
C.①②③
D.②③
参考答案:C
本题解析:分析:①根据m=n×M,算出质量判断;
②根据N=n×NA,算出分子数判断;
③先根据N=n×NA算出分子数,然后根据每个分子中含有的原子数算出原子总数判断.
解答:①氮气的质量:m=n×M=1.0mol×28g/mol=28g,一氧化碳的质量m=n×M=1.0mol×28g/mol=28g,质量相等,故①正确;
②氮气的分子数:N=n×NA=1.0mol×6.02×1023个/mol=6.02×1023个,一氧化碳的分子数:N=n×NA=1.0mol×6.02×1023个/mol=6.02×1023个,分子数相等,故②正确;
③氮气的分子数:N=n×NA=1.0mol×6.02×1023个/mol=6.02×1023个,每个分子中含两个原子,所以原子总数为2×6.02×1023个,一氧化碳的分子数:N=n×NA=1.0mol×6.02×1023个/mol=6.02×1023个,每个分子中含两个原子,所以原子总数为2×6.02×1023个,所以原子总数相等,故③正确;
故选C.
点评:本题考查物质的量的计算,难度不大,了解质子数与原子序数的关系是解本题的关键,元素无论变成哪种微粒,质子数和原子序数始终不变.
本题难度:一般
4、选择题 对于0.1molH2O,下列说法正确的是
A.含有6.02×1023个H2O分子
B.含0.1molH原子
C.含0.1molO原子
D.含原子总数为0.3
参考答案:C
本题解析:分析:A、每摩尔微粒含有阿伏伽德罗常数个微粒,约为6.02×1023.
B、1个水分子含有2个H原子.
C、1个水分子含有1个O原子.
D、1个水分子含有3个原子(2个H原子、1个O原子).
解答:A、0.1molH2O,约含有6.02×1022个H2O分子,故A错误;
B、1个水分子含有2个H原子,所以0.1molH2O,含0.2molH原子,故B错误;
C、1个水分子含有1个O原子,所以0.1molH2O,含0.1molO原子,故C正确;
D、1个水分子含有3个原子(2个H原子、1个O原子),所以0.1molH2O,约含原子总数为1.806×1023个原子,故D错误.
故选:C.
点评:考查物质的量相关计算,难度较小,注意基础知识的掌握.
本题难度:一般
5、选择题 下列关于0.05mol/L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1?L溶液中K+的浓度是0.20?mol/L
D.2?L溶液中含有SO42-的浓度是0.3mol/L
参考答案:B
本题解析:分析:A、根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有3mol离子(2mol钾离子,1mol硫酸根离子),再根据N=nNA计算离子的数目;
B、根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有3mol离子(2mol钾离子,1mol硫酸根离子),再根据N=nNA计算离子的数目;
C、每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍;
D、溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度.
解答:A、1L溶液中所含K+、SO42-总数为1L×0.05mol/L×3×NAmol-1=0.15NA,故A错误;
B、1L溶液中含有K+离子数为1L×0.05mol/L×2×NAmol-1=0.1NA,故B正确;
C、0.05mol/L K2SO4溶液,每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍,所以K+离子浓度是0.1mol/L,故C错误;
D、溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度为0.05mol/L,故D错误.
故选B.
点评:本题考查溶液物质的量浓度,比较基础,注意溶液是均一的,浓度与体积无关.
本题难度:一般