微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 草木灰中富含钾盐,主要成分是碳酸钾,还可能含有少量硫酸钾、氯化钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32-、SO42-和 Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③??????????,④?????????????,⑤冷却结晶。
(2)用托盘天平称量样品时,若某同学把样品放在右盘,砝码放在左盘,当天平平衡时读数为24.4g(一克以下用游码) ,则样品的实际质量为????????????
(3)在进行②、③、④ 操作时,都要用到玻璃棒,其作用分别是:___________________、___________________、________________________。
(4)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察到的现象为??????????????????????????,证明溶液中有CO32-离子。
②如何在第二支试管里检验SO42-的存在?????????????????????????????????,写出此过程中涉及反应的离子方程式???????????????????????????????。
③在第三支试管里加适量的硝酸银,观察到有沉淀产生,由此证明溶液中一定含Cl-。判断并解释该结论是否严密??????????????????????。
参考答案:(1)过滤,取滤液??(1分)?蒸发滤液(1分)
(2
本题解析:略
本题难度:简单
2、实验题 某研究性学习小组对某工业城市的空气污染进行了下列研究:
(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有:
A.使用石油液化气;B.燃烧含硫煤;C.粉尘污染。
另一同学认为还有一个不可排除的原因是:D._____________。目前城市空气污染的主要有害成分是___________________(用化学式表示)。
(2)研究性学习小组对该市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68。对此,你的合理的解释是________________________。形成酸雨的途径通常有两种说法,请用“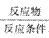 ”表示在空气中形成酸雨的两条途径:
”表示在空气中形成酸雨的两条途径:
①SO2________________________;
②SO2________________________。
(3)研究性学习小组的同学取相当于标准状况下的空气1.000L(含N2、O2、CO2、SO2等),缓缓通过足量的溴水,在所得溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。进行这一实验的目的是_______________________,通过计算得到的结论是_______________________________。
(4)该小组同学提出下列措施以减少空气污染的主要有害成分排放量,你认为合理的是_________。
①用天然气代替煤炭作民用燃料
②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高
④燃煤中加入适量石灰石后使用
(5)大气中的NOx不仅造成酸雨,还会形成对人体健康、植物生长都有害的光化学烟雾。硝酸工业、氮肥工业、冶金工业和汽车尾气等都产生大量NOx。请你提出NOx减少排放的两条措施。
①_____________________________,
②_____________________________。
参考答案:(1)机动车尾气污染;SO2
(2)雨水样品中的H2S
本题解析:
本题难度:一般
3、选择题 按如图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是( )
A.H2和Fe2O3
B.CO和CuO
C.H2和Na2CO3
D.CO和Na2CO3
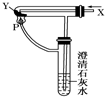
参考答案:A、氢气能燃烧,但是和氧化铁反应不会生成二氧化碳,不会看到澄
本题解析:
本题难度:一般
4、实验题 某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是???????。
第1组
| 第2组
| 第3组
|
S(单质)
| SO2、X、Na2SO3、NaHSO3
| SO3、H2SO4、Na2SO4、NaHSO4
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2?-76.1℃,SO3 ?16.8℃;沸点:SO2?-10℃,SO3?45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是?????????????????。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是????????????????????;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是???????????????????????????。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是????????????????????????????。
参考答案:(1)H2SO3 ?(2)①2SO2+O2
本题解析:
试题分析:(1)将相关的含硫物质依据硫元素化合价分组,依据低三族分类顺序,判断X为+4价的酸为H2SO3 ;
故答案为:H2SO3 ;
(2)①工业生产中SO2催化氧化的反应是二氧化硫的催化氧化反应;化学方程式为:2SO2+O2 2SO3; 2SO3;
故答案为;2SO2+O2 2SO3; 2SO3;
②装置II的作用是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III中高锰酸钾溶液会和二氧化硫反应逐渐褪色,生成Mn2+,二氧化硫被氧化为硫酸;
反应的离子方程式为:5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+;
故答案为:使SO3凝结成固体与SO2分离,5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+;
③若装置IV中有40mL 2.5mol?L-1NaOH溶液,反应后增重4.8g,吸收的为二氧化硫气体,依据二氧化硫物质的量和氢氧化钠物质的量进行分析判断生成产物,若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH=Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH=NaHSO3;装置IV中有40mL 2.5mol?L-1NaOH溶液中n(NaOH)=0.1mol,n(SO2)="4.8g÷64g/mol" =0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠,反应的化学方程式依据直平法写出:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O。
点评:本题考查了物质分类方法,规律总结,实验过程分析判断,化学方程式和离子方程式的书写,反应产物的分析判断,题目难度中等。
本题难度:简单
5、实验题 某化学学习小组利用如图所示装置来探究相应物质的化学性质。选择适当试剂完成实验A、B、C,并得出相应的实验结论。实验A、B、C所用试剂和所得结论列于表中。?????????
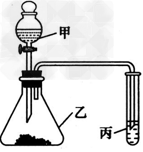 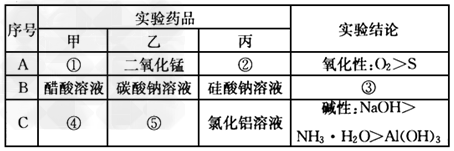
(1)乙装置的名称:_____________。 ????
(2)请填写①~⑤的试剂名称或实验结论:①___________;②__________;③________ ??;④___________;⑤______________。 ????
(3)小明利用该装置自行设计了一个实验——证明NO2具有氧化性(注:丙中已事先添加Na2S溶液)。据此回答下列问题: ????
①如何检验该装置的气密性:_______; ????
②打开甲装置的活塞后,装置乙中发生反应的化学方程式:___________; ????
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:__________ (用化学反应方程式和简要文字回答); ??
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:____________。
参考答案:(1)锥形瓶
(2)①双氧水(或过氧化氢溶液)??;
本题解析:
本题难度:一般
|